
题目列表(包括答案和解析)
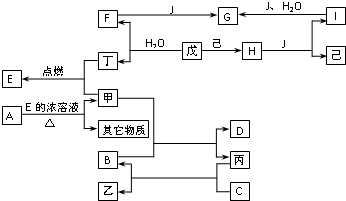 已知A、B、C、D、E、F、G、H、I、J是化合物,甲、已、丙、丁、戊、己是单质.其中,F、H、G、I焰色反应火焰呈黄色,B、C、D焰色反应透过钴玻璃观察火焰呈紫色,H是淡黄色固体.各物质间有如图所示的转化关系.
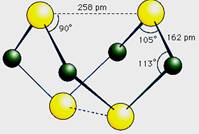
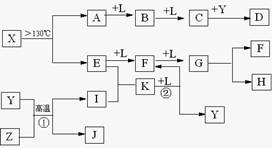
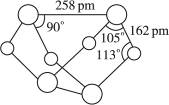
已知A、B、C、D、E、F、G、H、I、J是化合物,甲、已、丙、丁、戊、己是单质.其中,F、H、G、I焰色反应火焰呈黄色,B、C、D焰色反应透过钴玻璃观察火焰呈紫色,H是淡黄色固体.各物质间有如图所示的转化关系.已知A、E、I、L是常见的非金属单质,其中A为淡黄色固体,Z是常见的金属单质,B的相对分子质量比A大32,C的相对分子质量比B大16,Y是一种常见的液体,J是磁铁矿的主要成分,D、H、K均是重要的工业产品,X分子的球棍模型如图所示,图中部分反应条件已略去。
试回答下列问题
(1)写出化学式:D X 。
(2)E的电子式为: 。
(3)写出化学方程式:① ;② 。
已知A、E、I、L是常见的非金属单质,其中A为淡黄色固体,Z是常见的金属单质,B的相对分子质量比A大32,C的相对分子质量比B大16,Y是一种常见的液体,J俗称磁性氧化铁,D、H、K均是重要的工业产品,X分子的球棍模型如图所示,图中部分反应条件已略去。
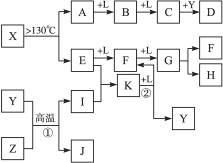
试回答下列问题:
(1)写出化学式:D____________、X____________。
(2)E的电子式为________________________。
(3)写出化学方程式:①______________________________________;
②____________________________________________________________。
在原子序数依次增大的4种短周期元素X、Y、Z、W,已知:
①X与Z、Y与W分别同族;
②X、Z、W分别与Y都可组成两种中学常见化合物;
③Y的阴离子与Z的阳离子的核外电子排布相同;
④这4种元素的单质中有一种为淡黄色固体。
(1)写出同时由X、Y、Z、W四种元素组成的
两种不同的化合物相互反应的化学方程式
。
(2)试比较:①Y、W对应气态氢化物的稳定性
> 。(填化学式,下同),②Y的阴离子与Z的阳离子半径大小 > 。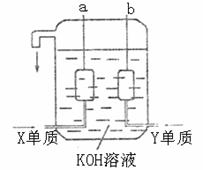
(3)用X、Y两元素的单质可制成已在阿波罗飞船中使用的新型电源,其结构如上图所示。两个电极均由多孔活性碳构成,通入的两种单质由孔隙逸出的电极表面放电。
①a是电源的 极,电极反应式是 ;
②b电极上的电极反应式是 。

请回答:
(1)欲实现上图的转化,在X、Y、Z中最多有______种是金属元素。
(2)若甲、乙分子中均含有10个电子,且甲分子中含有3个原子,乙分子中含有4个原子,则乙是_________,丙是_________。
(3)若甲和单质Z均为淡黄色固体,则甲和水反应的化学方程式为______________;已知
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com