(2009?朝阳区一模)碱式碳酸铜是孔雀石的主要成分,加热时可分解为氧化铜、二氧化碳和水三种氧化物.
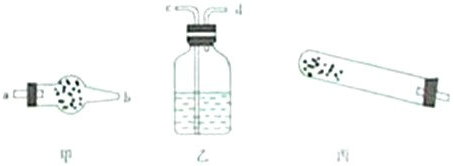
(1)若用下列仪器对分解产物中的非固体氧化物进行验证,仪器接口顺序是
e a b c d
e a b c d
(填字母).

按仪器连接顺序将仪器名称和对应仪器所装药品的名称填入下表.
| 仪器 |
试管 |
干燥管 干燥管 |
洗气瓶 洗气瓶 |
| 药品 |
碱式碳酸铜 |
无水硫酸铜 无水硫酸铜 |
澄清石灰水 澄清石灰水 |
还需使用的玻璃仪器是
酒精灯
酒精灯
.
(2)待(1)加热分解完全的试管冷却后,加入盐酸充分反应,CuO部分溶解,过滤:
①所得滤液中各种离子的物质的量浓度由大到小的顺序是
c(Cl-)>c(Cu2+)>c(H+)>c(OH-)
c(Cl-)>c(Cu2+)>c(H+)>c(OH-)
.
②将滤渣洗涤干燥,置于酒精蒸汽中并加热,黑色粉状固体逐渐变成红色固体,同时产生一种在常温下有刺激性气味的液体,该反应的化学方程式是
CuO+CH
3CH
2OH
CH
3CHO+Cu+H
2O
CuO+CH
3CH
2OH
CH
3CHO+Cu+H
2O
.
(3)将碱式碳酸铜与过量的木炭混合加热,也能得到(2)②所得的红色固体,该反应的化学方程式是
Cu
2(OH)
2CO
3+C
2Cu+2CO
2↑+H
2O
Cu
2(OH)
2CO
3+C
2Cu+2CO
2↑+H
2O
.
(4)铜及其合金用途广泛,常见的铜的合金有黄铜(铜锌合金)、青铜(铜锡合金)等.现有 w g黄铜样品,放入足量的稀盐酸中,产生V mL气体(标准状况下),则样品中铜和锌的物质的量之比是
(用含w、V的代数式表示).


 铁是人类生产和生活中必不可少的重要金属(如图).
铁是人类生产和生活中必不可少的重要金属(如图).