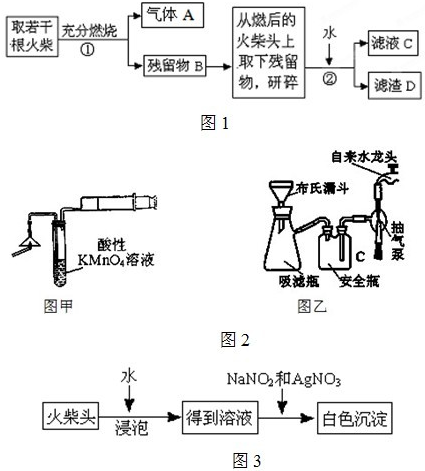
硫化钠和碳酸钠为原料、采用下述装置制备硫代硫酸钠,制备反应可表示为:
2Na
2S+Na
2CO
3+4SO
2=3Na
2S
2O
3+CO
2.根据要求回答问题:

(1)实验时,打开K1,关闭K2,最后洗气瓶中发生反应的离子方程式是
CO2+2OH-=CO32-+H2O、SO2+2OH-=SO32-+H2O
CO2+2OH-=CO32-+H2O、SO2+2OH-=SO32-+H2O
.
(2)锥形瓶内溶液pH小于7时会导致产品分解,因此实验过程中需要控制锥形瓶内溶液的pH.
①反应过程中,锥形瓶中溶液pH将
减小
减小
(填“增大”、“减小”或“保持不变”).
②测量锥形瓶中溶液pH时,用注射器吸取溶液样品比直接打开锥形瓶中瓶塞取样,除操作简便外,还具有的优点是
防止二氧化硫污染空气
防止二氧化硫污染空气
.
③若实验过程中测得溶液pH已接近于7.此时应该进行的操作是
关闭K1,打开K2
关闭K1,打开K2
.
(3)已知:2Na
2 S
2O
3+I
2=2NaI+Na
2 S
4O
6.实验结束后进行相关处理,可即获得Na
2 S
2O
3?5H
2O晶体.为测量其纯度,取晶体样品mg,加水溶解后,滴入几滴淀粉溶液,用0.010mol/L碘水滴定到终点时,消耗碘水溶液vmL,则该样品纯度是
(4)制取硫代硫酸钠的另一种方法是直接将硫粉和亚硫酸钠、水混合共热制取.为探究制取硫代硫酸钠最佳条件(溶液pH、亚硫酸钠浓度、反应温度、硫粉质量),设计如下对比实验(每次实验时亚硫酸钠质量均为63g,反应时间为30min):
| 实验序号 |
溶液pH |
亚硫酸钠与水的质量比 |
反应温度 |
硫粉质量 |
亚硫酸钠转化率 |
| 1 |
10 |
1.5:1 |
100 |
18 |
80.7% |
| 2 |
a |
1.1:1 |
100 |
18 |
94.6% |
①实验1、2的目的是探究亚硫酸钠浓度对亚硫酸钠转化率的影响,则a=
10
10
②若还要探究溶液pH、反应温度、硫粉质量对亚硫酸钠转化率的影响,除实验1、2外,至少还需进行
3
3
次对比实验.
③实验表明:亚硫酸钠转化率不受硫粉质量多少的影响.为什么?答:
硫为固体,不影响平衡的移动
硫为固体,不影响平衡的移动
.

 (2014?滨州一模)固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:
(2014?滨州一模)固定和利用CO2,能有效地利用资源,并减少空气中的温室气体.工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是: