
(2010?桂林二模)某课外实验小组设计了如图所示装置进行“一器多用”的实验探究(夹持装置已略去).
(1)该小组同学用该装置进行“H
2的制取及燃烧性质验证”实验.他们设计了如下的实验步骤:
a.组装装置并检验气密性
b.装入药品,关闭活塞m和n,固定在铁架台上
c.打开分液漏斗活塞m,使反应开始
d.当观察到B中有较多气体时,打开活塞n并点燃气体
回答下列问题:
①以上某步骤中有一处明显的操作错误,请指出错误之处
d步骤中在点燃H2前没有先验纯.
d步骤中在点燃H2前没有先验纯.
②该小组同学在进行c步骤操作时,发现分液漏斗中的溶液不能滴下,你认为可能的原因有
一是分液漏斗的玻璃塞没有打开,二是量气管中液面高于分液漏斗中液面.
一是分液漏斗的玻璃塞没有打开,二是量气管中液面高于分液漏斗中液面.
.
(2)该装置还可用于制取并收集少量其他气体,用字母代号填空:下列气体中哪些可以用该装置来制取和收集
A、B、E
A、B、E
;若将装置B中的水换成CCl
4,下列气体中哪些可以用该装置来制取和收集
A、B、C、D
A、B、C、D
.
A.O
2 B.NO C.SO
2 D.NH
3 E.C
2H
2 F.C
2H
4(3)该小组同学用该装置进行定量实验,以确定某稳定饱和脂肪醇的结构.
①反应前,先对量气管进行第一次读数,读数为40.0mL,然后在A中加入5gNa和0.62g待测醇,充分反应后,再进行第二次读数,读数为264.0mL(所有数据均已换算成标准状况时的数值).读数时要注意的是:一是使视线与凹液面最低处相平,二是
保持装置A和装置B液面相平
保持装置A和装置B液面相平
.
②为了进一步确定该醇的结构,又将0.62g该醇充分燃烧,可以生成0.02mol的CO
2和0.03mol的H
2O,已知两个或者两个以上的羟基连在同一个C原子上不能形成稳定的醇,根据上述信息计算确定该饱和醇的结构简式为
CH2OHCH2OH
CH2OHCH2OH
.

 (2010?桂林二模)某课外实验小组设计了如图所示装置进行“一器多用”的实验探究(夹持装置已略去).
(2010?桂林二模)某课外实验小组设计了如图所示装置进行“一器多用”的实验探究(夹持装置已略去).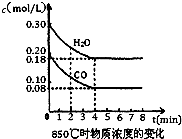 已知反应:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41.2kJ/mol,生成的CO2与H2以不同的体积比混合时在合适条件下的反应可制得CH4.
已知反应:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41.2kJ/mol,生成的CO2与H2以不同的体积比混合时在合适条件下的反应可制得CH4.

