
题目列表(包括答案和解析)
(6分)处理含CN- (其中C为+ 2价)的工业废水常用Cl0_氧化,生成的CNO (其中C为+4价),反应的离子方程式为: 
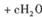 ,上述离子方程式可能的配平系数有多组。请回答:
,上述离子方程式可能的配平系数有多组。请回答:
(1) 该离子方程式中e:f的值是________(填选项标号)。
A.0.5 B. 1 C.2 D.不能确定
(2) 若d=e =l,则 b=________[来源:学*科*网]
(3)若反应中转移1.2mol电子,则生成的气体在标况的体积是________。
(6分)处理含CN- (其中C为+ 2价)的工业废水常用Cl0_氧化,生成的CNO (其中C为+4价),反应的离子方程式为: ,上述离子方程式可能的配平系数有多组。请回答:
(1) 该离子方程式中e:f的值是________(填选项标号)。
A.0.5 B.1 C.2 D.不能确定
(2) 若d=e =l,则 b=________
(3)若反应中转移1.2mol电子,则生成的气体在标况的体积是________。
(5分) (1)常温下,pH=11的NaOH溶液稀释1000倍后溶液的pH为 ,稀释105倍后溶液的pH为
(2)在pH为11的Ba(OH)2溶液中,溶质的物质的量浓度为 mol/L,水电离出的C(OH-)为 mol/L
(3)25℃时,将pH=10和pH=12的NaOH溶液等体积混合,混合后溶液的pH= 。
(5分) (1)常温下,pH=11的NaOH溶液稀释1000倍后溶液的pH为 ,稀释105倍后溶液的pH为
(2)在pH为11的Ba(OH)2溶液中,溶质的物质的量浓度为 mol/L,水电离出的C(OH-)为 mol/L
(3)25℃时,将pH=10和pH=12的NaOH溶液等体积混合,混合后溶液的pH= 。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第八列 |
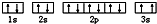 该同学所画的电子排布图违背了
该同学所画的电子排布图违背了湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com