
题目列表(包括答案和解析)
在下列反应中,其离子方程式可以用H+ + OH-= H2O表示的是( )
A.Mg(OH)2溶液与稀盐酸 B.Cu(OH)2与HNO3
C.NaOH溶液与HNO3溶液 D.Ba(OH)2溶液与稀H2SO4
在下列反应中,其离子方程式可以用H++OH-=H2O表示的是 ( )
A. Ba(OH)2溶液与稀硫酸反应 B. Cu(OH)2与稀硝酸反应
C. Ca(OH)2溶液与盐酸反应 D. Al(OH)3与盐酸反应
在下列反应中,其离子方程式可以用H+ + OH-= H2O表示的是( )
| A.Mg(OH)2溶液与稀盐酸 | B.Cu(OH)2与HNO3 |
| C.NaOH溶液与HNO3溶液 | D.Ba(OH)2溶液与稀H2SO4 |
(14分)在化学反应中,只要物质所含元素的化合价发生变化的反应就是氧化还原反应。例如:2Na+C12 =2NaCl,反应前后,Na元素、Cl元素的化合价分别发生了变化,该反应是氧化还原反应。
(1)根据化合价是否变化分析,下列反应(部分反应条件略去)属于氧化还原反应的是
(填写序号);
①C+O2 == CO2 ②CaO+H2O==Ca(OH)2 ③CaCO3==CaO+CO2↑
④2H2O2 == 2H2O+O2↑ ⑤CO+CuO=Cu+CO2 ⑥HCl+NaOH=NaCl+H2O
(2) 含有高价态元素的化合物,通常具有氧化性,如在氯化铁溶液中,氯化铁能将单质铜氧化成氯化铜,自身被还原成氯化亚铁。试回答下列问题:
①该反应的化学方程式可表示为 ;
②向上述反应后的溶液中加入过量的锌粉充分反应后过滤,则滤纸上一定有的固体是
(写化学式,下同),滤液中的溶质是 。
(3) 通过进一步定量分析上述氧化还原反应的化合价变化发现:氧化还原反应中其元素化合价升高总数 (填“大于”、“等于”或“小于”)化合价降低升高总数。氟气是氧化性最强的非金属单质,在加热条件下,等物质的量的F2和烧碱完全反应,生成NaF、H2O和另一种气体,该气体可能是_______。 (写化学式)
(4)柠檬果汁中含有维生素C(C6H8O6,简写成Vc)是还原剂,它能被I2氧化生成C6H6O6。当前市场上测定柠檬果汁中Vc含量的方法是取10.00mL果汁,用醋酸酸化,再加入20.00mL 0.02500 mol?dm-3标准碘溶液,然后以淀粉溶液作指示剂,最后用0.01000 mol?dm-3Na2S2O3标准溶液滴定过量的I2,消耗Na2S2O3溶液10.00mL。
①Vc中碳元素的平均化合价是 。
②写出Vc与I2反应的离子方程式。
③此份果汁中含Vc= mg/100mL果汁。
(1).
下列有关电化学的图示中,完全正确的是________
(2).
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中可与碘化物作用生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.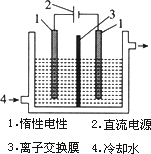
请回答下列问题:
a.碘是________(填颜色)固体物质,实验室常用________方法来分离提纯含有少量泥沙杂质的固体碘.
b.电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH![]() 5KI+KIO3+3H2O,将该溶液加入阳极区.另将氢氧化钾溶液加入阴极区,电解槽用水冷却.
5KI+KIO3+3H2O,将该溶液加入阳极区.另将氢氧化钾溶液加入阴极区,电解槽用水冷却.
电解时,阳极上发生反应的电极反应式为________,每生成1 mol KIO3,电路中通过的电子的物质的量为________.
c.电解过程中,为确定电解是否完成,需检验电解液中是否有I-.请设计一个检验电解液中是否有I-的简单实验方案,并按要求填写下表.
![]()
可供选择的试剂有淀粉溶液,稀硫酸,氯化钠溶液,酒精等.(用其中的一种或多种均可.)
d.电解完毕,从电解液中得到碘酸钾晶体的实验过程如下:
阳极电解液→①蒸发浓缩→②→③过滤→④洗涤→⑤→碘酸钾晶体
步骤②的操作名称是________,步骤⑤的操作名称是________.步骤④洗涤晶体的目的是________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com