
题目列表(包括答案和解析)
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。

(1)在以上字母表示的短周期主族元素中,原子半径最大的是__________(填元素符号)。
(2)i元素在周期表中的位置是__________。运用元素周期律判断,i元素的正二价硫酸盐是__________(难溶或易溶)于水的固体。
(3)请用电子式表示a与g组成的化合物的形成过程____________________。
(4)X、Y为同周期金属元素,它们简单离子的电子层与d离子的电子层结构相同,Y离子半径在同周期元素简单离子半径中最小,X、Y两元素最高价氧化物对应的水化物之间可以相互反应生成盐和水,写出该反应的离子方程式____________________;X与d的单质在加热条件下生成的化合物中存在的化学键类型是____________________。
(5)工业上制取Y和g的无水化合物方法如下:Y的氧化物与b、g的单质在高温条件下反应,每消耗6 kg b的单质,过程中转移1×10 mol电子,写出相应反应的化学方程式_______。
mol电子,写出相应反应的化学方程式_______。
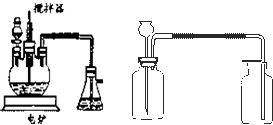 在中学化学实验中,通常用无水硫酸铜检验少量水的存在.由于无水硫酸铜吸湿性很强,需要现制现用.
在中学化学实验中,通常用无水硫酸铜检验少量水的存在.由于无水硫酸铜吸湿性很强,需要现制现用.
| ||
| ||
| ||
| ||


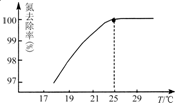 氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.
氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.- 4 |
- 4 |
2- 4 |
2- 8 |
2- 8 |
+ 4 |
+ 4 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com