
题目列表(包括答案和解析)
在学习“几种重要的金属化合物”时,同学上台演示以下两个实验:
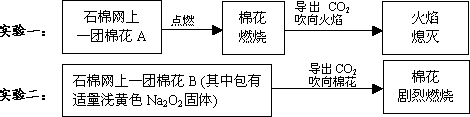
(1)提出问题 教师引导:实验一CO2能灭火,实验二的CO2为何能“点火”?
(2)假设与猜想 ①Na2O2与CO2发生了反应,可能有Na2CO3生成;②棉花燃烧,说明该反应放热,使温度达到了棉花的着火点;③剧烈燃烧,反应中可能有________生成.
(3)设计并进行实验,观察、解释和结论 请你帮助他们完成下表:

(4)类比推理 Na2O2与H2O反应后应该有NaOH和O2生成.则向包有Na2O2的棉花上滴两滴水,棉花也应剧烈燃烧;向生成的溶液中滴入酚酞应该变红色.
(5)实验与解释
①向小烧杯(底部垫砂)中包有Na2O2的脱脂棉上滴两滴水,发现有气泡产生,杯底发热,但棉花没有燃烧,其原因可能是__________________________;
②向杯中的溶液滴入酚酞,溶液变红色,振荡后红色消失,其原因可能是______________________________;
(6)联想与启示:保存Na2O2的注意事项为:______________________.
| 观察要点或实验步骤 | 现象、结论或注意事项 | |
| 方法一 | 观察二者外观上的细小差别 | 呈 白色粉末 白色粉末 状的是碳酸钠,呈白色细小晶体 白色细小晶体 的是碳酸氢钠 |
| 方法二 | 分别滴入几滴水 | 结成块状并且试管底部温度较高的是 碳酸钠 碳酸钠 ;未结块并且试管底部温度较低的是 碳酸氢钠 碳酸氢钠 . |
| 方法三 | 再分别加入10mL水,滴入 1~2滴酚酞试液 |
该操作中加入水后应 用力振荡或用玻璃棒搅拌 用力振荡或用玻璃棒搅拌 ;滴入酚酞后应着重观察 所得溶液颜色的深浅 所得溶液颜色的深浅 . |
 高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.
高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.| 滴入高锰酸钾溶液的次序(每滴溶液的体积相同) | 高锰酸钾溶液紫色褪去的时间 |
| 先滴入第1滴 | 1min |
| 褪色后再滴入第2滴 | 15s |
| 褪色后再滴入第3滴 | 3s |
| 褪色后再滴入第4滴 | 1s |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com