
题目列表(包括答案和解析)
(13分)Ⅰ.(1)反应I2+2S2O32—=2I—+S4O62—常用于精盐中碘含量测定。某同学利用该反应探究浓度对反应速率的影响。实验时均加入1mL淀粉溶液做指示剂,若不经计算,直接通过褪色时间的长短判断浓度与反应速率的关系,下列试剂中应选择______(填序号)。
①1mL 0.01 mol?L—1的碘水 ②1mL 0.001 mol?L—1的碘水
③4mL 0.01 mol?L—1的Na2S2O3溶液 ④4mL 0.001 mol?L—1的Na2S2O3溶液
(2)若某同学选取①③进行实验,测得褪色时间为4s,计算v(S2O32—)=_______________。
Ⅱ.合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g) 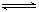 CO2(g)+H2(g) ΔH <0,200℃时,该反应的平衡常数为1/2.25,该温度下,将一定量的CO和H2投入某10L密闭容器,5min时达平衡,各物质浓度(mol?L—1)变化如下:
CO2(g)+H2(g) ΔH <0,200℃时,该反应的平衡常数为1/2.25,该温度下,将一定量的CO和H2投入某10L密闭容器,5min时达平衡,各物质浓度(mol?L—1)变化如下:
| | 0min | 5min | 10min |
| CO | 0.01 | | 0.0056 |
| H2O | 0.01 | | 0.0156 |
| CO2 | 0 | | 0.0044 |
| H2 | 0 | | 0.0044 |
(13分)Ⅰ.(1)反应I2+2S2O32—=2I—+S4O62—常用于精盐中碘含量测定。某同学利用该反应探究浓度对反应速率的影响。实验时均加入1mL淀粉溶液做指示剂,若不经计算,直接通过褪色时间的长短判断浓度与反应速率的关系,下列试剂中应选择______(填序号)。
①1mL 0.01 mol•L—1的碘水 ②1mL 0.001 mol•L—1的碘水
③4mL 0.01 mol•L—1的Na2S2O3溶液 ④4mL 0.001 mol•L—1的Na2S2O3溶液
(2)若某同学选取①③进行实验,测得褪色时间为4s,计算v(S2O32—)=_______________。
Ⅱ.合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH <0,200℃时,该反应的平衡常数为1/2.25,该温度下,将一定量的CO和H2投入某10L密闭容器,5min时达平衡,各物质浓度(mol•L—1)变化如下:
CO2(g)+H2(g) ΔH <0,200℃时,该反应的平衡常数为1/2.25,该温度下,将一定量的CO和H2投入某10L密闭容器,5min时达平衡,各物质浓度(mol•L—1)变化如下:
|
|
0min |
5min |
10min |
|
CO |
0.01 |
|
0.0056 |
|
H2O |
0.01 |
|
0.0156 |
|
CO2 |
0 |
|
0.0044 |
|
H2 |
0 |
|
0.0044 |
(1) 请分别计算CO、H2O、CO2、H2的平衡浓度__________,_________,________,_______。
(2)CO的平衡转化率为____________,欲提高CO的转化率,下列措施中可行的是_____(填序号)。
a.增加压强 b.降低温度
c.体积不变,再充入CO d.更换催化剂
e.体积不变,再充入0.1molH2O
(3) 若5min~10min只改变了某一条件,该条件是__________,如何改变的___________。
硫酸亚铁铵是一种常用化学试剂,其晶体[(NH4)2Fe(SO4)2·6H2O]溶于水电离成简单离子,在乙醇中溶解度很小。
Ⅰ、硫酸亚铁铵晶体的制取
①用热的Na2CO3溶液洗涤除去铁屑表面油污;②用蒸馏水洗涤铁屑;③将铁屑溶于足量稀硫酸,过滤;④滤液中加入(NH4)2SO4固体,经溶解、蒸发结晶、过滤、洗涤、干燥得硫酸亚铁按晶体。
(1)用热的Na2CO3溶液除去油污的原理是 。
(2)铁屑因被空气氧化含少量Fe2O3,加稀H2SO4时Fe2O3会溶解产生少量Fe3+,但铁屑被H2SO4充分溶解后的溶液中并未检测出Fe3+,用离子方程式说明原因: 。
(3)步骤④中过滤得到的晶体表面含少量水,可用无水乙醇洗涤除去。需要用无水乙醇洗涤的理由是 。
Ⅱ.测定产品中各种离子含量
(4)称取ag产品,准确配制250mL溶液,取出25.00 mL溶液,加入足量BaCl2溶液,然后过滤、洗涤沉淀、烘干称重,得到bg沉淀。ag产品中含SO42—的物质的量为 mol。
(5)取(4)所配溶液25.00 mL放入锥形瓶,加入足量稀H2SO4,然后用0.1000mol·L—1,KMnO4溶 液滴定,终点时消耗20.00mL KMnO4溶液。滴定时反应的离子方程式(未配平)为: Fe2++ H++ MnO4—= Fe3++ Mn2++ H2O
①配平上述离子方程式,并标明电子转移的方向和总数。
②若上述数据只由一次滴定测得,某同学据此计算出ag产品中Fe2+含量为0.1mol。该同学得出结果的做法是否合理,请说明理由: 。
(6)另取ag产品,放入烧瓶中,加入足量NaOH溶液,产生气体用足量稀H2SO4吸收。实验前后稀H2SO4增重cg。实验装置如图。

结果表明按该方案测定NH4+的量时会产生较大误差,请对如 下两种情况的原因进行分析:
①NH4+测定结果偏高,原因可能 ;
②NH4+测定结果偏低,原因可能 。
硫酸亚铁铵是一种常用化学试剂,其晶体[(NH4)2Fe(SO4)2·6H2O]溶于水电离成简单离子,在乙醇中溶解度很小。
Ⅰ、硫酸亚铁铵晶体的制取
①用热的Na2CO3溶液洗涤除去铁屑表面油污;②用蒸馏水洗涤铁屑;③将铁屑溶于足量稀硫酸,过滤;④滤液中加入(NH4)2SO4固体,经溶解、蒸发结晶、过滤、洗涤、干燥得硫酸亚铁按晶体。
(1)用热的Na2CO3溶液除去油污的原理是 。
(2)铁屑因被空气氧化含少量Fe2O3,加稀H2SO4时Fe2O3会溶解产生少量Fe3+,但铁屑被H2SO4充分溶解后的溶液中并未检测出Fe3+,用离子方程式说明原因: 。
(3)步骤④中过滤得到的晶体表面含少量水,可用无水乙醇洗涤除去。需要用无水乙醇洗涤的理由是 。
Ⅱ.测定产品中各种离子含量
(4)称取ag产品,准确配制250mL溶液,取出25.00 mL溶液,加入足量BaCl2溶液,然后过滤、洗涤沉淀、烘干称重,得到bg沉淀。ag产品中含SO42—的物质的量为 mol。
(5)取(4)所配溶液25.00 mL放入锥形瓶,加入足量稀H2SO4,然后用0.1000mol·L—1,KMnO4溶 液滴定,终点时消耗20.00mL KMnO4溶液。滴定时反应的离子方程式(未配平)为: Fe2++ H++ MnO4—= Fe3++ Mn2++ H2O
①配平上述离子方程式,并标明电子转移的方向和总数。
②若上述数据只由一次滴定测得,某同学据此计算出ag产品中Fe2+含量为0.1mol。该同学得出结果的做法是否合理,请说明理由: 。
(6)另取ag产品,放入烧瓶中,加入足量NaOH溶液,产生气体用足量稀H2SO4吸收。实验前后稀H2SO4增重cg。实验装置如图。
结果表明按该方案测定NH4+的量时会产生较大误差,请对如 下两种情况的原因进行分析:
①NH4+测定结果偏高,原因可能 ;
②NH4+测定结果偏低,原因可能 。

| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com