
题目列表(包括答案和解析)
化合物KxFe(C2O4)y·3H2O(Fe为+3价)是一种光敏材料,实验室可以用如下方法来制备这种材料并测定这种材料的组成:
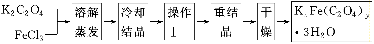
(1)结晶时应将溶液用冰水冷却置于在黑暗处等待晶体的析出,这样操作的原因是:________________________________________________________________________。
(2)操作Ⅰ的名称是______________________。
(3)称取一定质量的晶体置于锥形瓶中,加入足量的蒸馏水和稀H2SO4,将C2O42-转化为H2C2O4后用0.100 0 mol·L-1KMnO4溶液滴定,当消耗KMnO4溶液24.00 mL时恰好完全反应,H2C2O4与酸性KMnO4溶液反应的化学方程式是:__________________________。再向溶液中加入适量的还原剂,恰好将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定。当Fe2+完全氧化时,用去KMnO4溶液4.00 mL,此滴定反应的离子方程式是____________。
(4)配制100 mL 0.100 0 mol·L-1KMnO4溶液及滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有________(填仪器名称)。滴定终点时溶液颜色为________色,且30秒内不变色。
(5)经计算,化合物KxFe(C2O4)y·3H2O中,x=________。
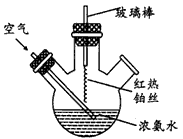

 氯水是实验室常需临时配制的一种试剂.图甲所示的是实验室配制氯水时的一种常用装置,图乙是某化学实验小组自行设计的一种配制氯水的装置(图中的鼓气球是一种具有气体单向阀的可用于向瓶中鼓入空气的仪器).
氯水是实验室常需临时配制的一种试剂.图甲所示的是实验室配制氯水时的一种常用装置,图乙是某化学实验小组自行设计的一种配制氯水的装置(图中的鼓气球是一种具有气体单向阀的可用于向瓶中鼓入空气的仪器).
| ||
| ||
长期存放在Na2SO3会被空气中的氧气部分氧化。某化学兴趣小组通过实验测不定期某无水Na2SO3被氧化的程度。
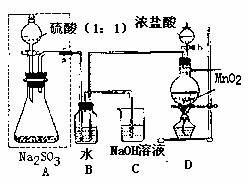
请回答:
(1)若将虚线框内的分液漏斗换成长颈漏斗,是应如何检查虚线框内装置的气密性?
。
(2)写出B装置中反应的离子方程式 。
(3)称量a g Na2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量BaC12溶液充分反应,过滤、洗涤、干燥、称量得白色沉淀b g,则样品中的Na2SO3的质量分数为 。
(4)深入研究发现,是述实验方案存在缺陷,致使测得的Na2SO3质量分数偏小,试分析其中的原因(列出一条即可) 。
(Ⅱ)乙同学设计了另一套实验装置如下图:
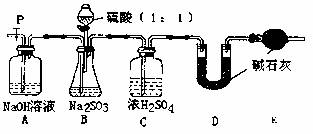
(5)实验中待锥形瓶中不再产生气体后,打开活塞P从导管左端缓缓鼓入一定量的空气,这样做的目的是 。
(6)除已称量的a g Na2SO4样品外,实验中还应测定的数据是 (填图中字母)装置实验前后的质量差。
(Ⅲ)现有以下试剂:蒸馏水、盐酸、稀硝酸、BaC12溶液、Ba(NO3)2溶液。
(7)丙同学欲从中选择合适试剂,来测定已知质量为a g的Na2SO3样品中Na2SO3的质量分数,下述实验方案理论上可行的有 。
A.将样品溶解,加足量盐酸,再加足量BaC12溶液,过滤、洗涤、干燥、称量沉淀m1g
B.将样品溶解,加足量盐酸,再加足量BaC12溶液,过滤、洗涤、干燥、称量沉淀m2g
C.将样品溶解,加过量BaC12溶液,过滤后,将虑液蒸干,称量得固体m3g
D.将样品溶液,加过量Ba(NO3)2溶液,过滤、洗涤,在沉淀中加入足量盐酸,再过滤、洗涤、干燥、称量得固体m4g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com