
题目列表(包括答案和解析)
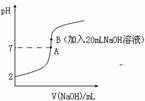
氢氟酸(HF)是一元弱酸,在水溶液中的电离方程式为:HF![]() H++F-。25℃下,向20mL0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示。
H++F-。25℃下,向20mL0.2mol•L-1的氢氟酸中滴加0.2mol•L-1的NaOH溶液时,溶液的pH变化如图所示。
 已知:电离度(
已知:电离度(![]() )和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力。
)和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力。![]()
请回答下列问题:
(1)在氢氟酸的稀溶液中,通过改变以下条件能使氢氟酸的电离度[![]() (HF)]增大的是_______,可使氢氟酸的电离平衡常数[Ka(HF)] 增大的是__________。
(HF)]增大的是_______,可使氢氟酸的电离平衡常数[Ka(HF)] 增大的是__________。
a.升高温度 b.向溶液中滴入2滴浓盐酸 c.加入少量NaF固体 d.加水稀释
(2)在此温度下,氢氟酸的电离平衡常数Ka(HF)为:__ ,
电离度![]() 为_ _%。
为_ _%。
(3)下列有关图中各点微粒浓度关系正确的是_______________。
a.在A处溶液中:c(F—)+c(HF)=0.2 mol•L-1
b.在B处溶液中:c(H+)+c(HF)= c(OH—)
c.在B处溶液中:c(Na+)>c(F—)>c(H+)>c(OH—)
d.在A和B处溶液中都符合:![]() = Ka(HF)
= Ka(HF)
(4)已知该温度下Ksp(CaF2)=1.5×10-10。取B点时的溶液10mL与90mL1×10-4 mol·L-1 CaCl2溶液混合,通过列式计算说明是否有沉淀产生。
(一)(1)甲烷也是一种清洁燃料,但不完全燃烧时热效率降低并会产生有毒气体造成污染。
已知: CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) ΔH1=―890.3 kJ/mol
2CO (g) + O2(g) = 2CO2(g) ΔH2=―566.0 kJ/mol
则甲烷不完全燃烧生成一氧化碳和液态水时的热效率只是完全燃烧时的________倍(计算结果保留1位小数)。
(2)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol/L的氯化铜溶液的装置示意图: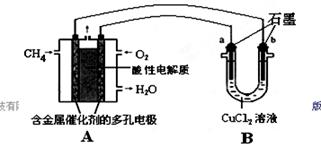
请回答:
①甲烷燃料电池的负极反应式是________。
②当线路中有0.1 mol电子通过时,________(填“a”或“b”)极增重________g。
(二)下表是几种弱电解质的电离平衡常数、难溶电解质的
溶度积Ksp (25℃)。
| 电解质 | 平衡方程式 | 平衡常数K | Ksp |
| CH3COOH | CH3COOH CH3COO-+H+ CH3COO-+H+ | 1.76×10-5 | |
| H2CO3 | H2CO3 H++HCO3- H++HCO3-HCO3-  H++CO32- H++CO32- | K1=4.31×10-7 K2=5.61×10-11 | |
| C6H5OH | C6H5OH  C6H5O-+H+ C6H5O-+H+ | 1.1×10-10 | |
| H3PO4 | H3PO4 H++H2PO4- H++H2PO4-H2PO4-  H++HPO32- H++HPO32-HPO42-  H++PO43- H++PO43- | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 | |
| NH3·H2O | NH3·H2O NH4++OH- NH4++OH- | 1.76×10-5 | |
| BaSO4 | BaSO4 Ba2++SO42- Ba2++SO42- | | 1.07×10-10 |
| BaCO3 | BaCO3 Ba2++CO32- Ba2++CO32- | | 2.58×10-9 |
(一) (1)甲烷也是一种清洁燃料,但不完全燃烧时热效率降低并会产生有毒气体造成污染。
已知: CH4(g) + 2O2(g) = CO2(g) + 2H2O(l) ΔH1=―890.3 kJ/mol
2CO (g) + O2(g) = 2CO2(g) ΔH2=―566.0 kJ/mol
则甲烷不完全燃烧生成一氧化碳和液态水时的热效率只是完全燃烧时的________倍(计算结果保留1位小数)。
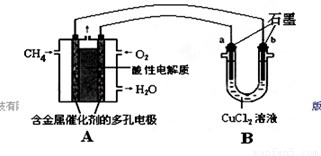
(2)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50 mL 2 mol/L的氯化铜溶液的装置示意图:
请回答:
①甲烷燃料电池的负极反应式是________。
②当线路中有0.1 mol电子通过时,________(填“a”或“b”)极增重________g。
(二)下表是几种弱电解质的电离平衡常数、难溶电解质的
溶度积Ksp (25℃)。
|
电解质 |
平衡方程式 |
平衡常数K |
Ksp |
|
CH3COOH |
CH3COOH |
1.76×10-5 |
|
|
H2CO3 |
H2CO3 HCO3- |
K1=4.31×10-7 K2=5.61×10-11 |
|
|
C6H5OH |
C6H5OH |
1.1×10-10 |
|
|
H3PO4 |
H3PO4 H2PO4- HPO42- |
K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
|
|
NH3·H2O |
NH3·H2O |
1.76×10-5 |
|
|
BaSO4 |
BaSO4 |
|
1.07×10-10 |
|
BaCO3 |
BaCO3 |
|
2.58×10-9 |
回答下列问题:
(1)由上表分析,若①CH3COOH ②HCO3- ③C6H5OH ④H2PO4- 均可看作酸,则它们酸性由强到弱的顺序为__________________________(填编号);
(2)25℃时,将等体积等浓度的醋酸和氨水混合,混合液中:c(CH3COO-)______c(NH4+);(填“>”、“=”或“<”)
(3)25℃时,向10ml 0.01mol/L苯酚溶液中滴加Vml 0.01mol/L氨水,混合溶液中粒子浓度关系正确的是( );
A.若混合液pH>7,则V≥10
B.若混合液pH<7,则c((NH4+) >c (C6H5O-) >c (H+)>c (OH-)
C.V=10时,混合液中水的电离程度小于10ml 0.01mol/L苯酚溶液中水的电离程度
D.V=5时,2c(NH3·H2O)+ 2 c (NH4+)= c (C6H5O-)+ c (C6H5OH)
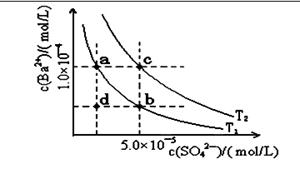
(4)如下图所示,有T1、T2两种温度下两条BaSO4在水中的沉淀溶解平衡曲线,回答下列问题:
讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法不正确的是( )
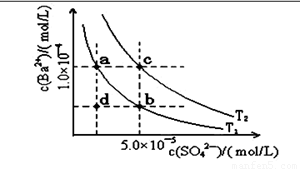
A.加入Na2SO4可使溶液由a点变为b点
B.在T1曲线上方区域(不含曲线)任意一点时, 均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由d点变为曲线上a、 b之间的某一点(不含a、b)
D.升温可使溶液由b点变为d点
 、Na+、H+,阴离子:Cl-、OH-、
、Na+、H+,阴离子:Cl-、OH-、 ),在水溶液中它们均抑制水电离.常温下各物质从1mL稀释到1000mL,PH的变化如图1所示,请回答:
),在水溶液中它们均抑制水电离.常温下各物质从1mL稀释到1000mL,PH的变化如图1所示,请回答:
| NH | + 4 |
| C2O | 2- 4 |

第Ⅰ卷
一、选择题,二、多选题
题号
1
2
3
4
5
6
7
8
9
10
答案
B
C
C
D
A
B
B
C
B
A
题号
11
12
13
14
15
16
17
18
19
20
21
答案
D
C
B
B
BC
ACD
B
AD
C
B
C
第Ⅱ卷
22(一)
(1)频率相同、位相差恒定………2分
(2)暗条纹…………………………2分
(3)19.22,  ………4分
………4分
(二)⑴A2………(2分)
V2………(2分)
⑵ ………(3分);
………(3分);
⑶ ………(2分),
………(2分),
U2表示电压表V2的示数,I2表示电流A2的示数.rV2表示电压表V2的内阻. ………(1分)
23、(16分)
解:由于月球引力提供向心力
 (4分)
(4分)
 (2分)
(2分)
由于地球引力提供月球运动的向心力
 (4分)
(4分)
 (2分)
(2分)
 (4分)
(4分)
24.解:(20分)①ab导体棒运动的最大速度时:
mgSinθ=BIι…………………………2分
I=BιV/3R…………………………………2分
 ………………………2分
………………………2分
②ab导体棒匀速运动时重力的功率、
P1=
V mgSinθ= ………………………3分
………………………3分
整个回路的电功率
P2= ………………………………3分
………………………………3分
通过计算说明是等大。
③对cd分析Mg= 2mgSinθ+ 2BIι= 4mgSinθ…………………3分
M≥4mSinθ…………………………………………………………3分
25.解:(18分)①对n个小车m和M用动量守恒定律
mV0=nmV1=(nm+M)V2………………………6分
物体的加速度a=μg………………………3分
t= ………………………3分
………………………3分
②由能量关系得μMgnL= ………………………4分
………………………4分
 ………………………4分
………………………4分
 26.(14分)
26.(14分)
⑴. (2分)
直线型 极性 极性 非极性(4分)
(2)③ ② (2分) (3)CH4 NH3 NH3 (3分)
⑷.3SO2
+ 2NO + 3Ba2+ + 2H2O
==== 3BaSO4 ↓ + 2NO + 4H+
(2分)SO2 (1分)
+ 3Ba2+ + 2H2O
==== 3BaSO4 ↓ + 2NO + 4H+
(2分)SO2 (1分)
27.(10分) (1)SO3 (1分)

(2) (2分)
(3)2Na2O2+2H2O
4Na++4OH-+O2↑ (2分) (4)Fe2O3+6H+ 2Fe3++3H2O (2分)
(5)FeS2(s)+11/4O2(g)
1/2 Fe2O3(s)+2SO2(g);△H=-852
kJ/mol (3分)
28.(18分)(1)Zn + 2H+ === Zn2+ + H2↑ (2分)
(2)装置I的不足是通过气体中含有HCl气体;装置II制备CaH2的装置后没有干燥装置。(各3分) (3)CB(4分)
(4)(不加热情况下)通氢气排完整套装置里的空气;验纯;点燃未反应的氢气。(不分前后)(4分) (5)CaH2 + 2H2O === Ca(OH)2 +H2↑(2分)]
 29.(16分)
29.(16分)
(1)
A; C (各2分)
(2) (3分)

(3)(各3分)

(4)(3分)
 或
或 
30.(16分,每空2分)
(1)第五组(或答含H2O + N + P + Mg + K的培养液)。
(2) 光照强度、温度、溶液通气状况等(至少写两种)但不能将“加入土壤”也作为变量)。
(3)每组栽培相同数量多株(必须两株以上,答一株者不给分)同种长势相同的植物;将五组植物放在相同适宜的光照、温度等条件下培养 。
(4) 4 。硫和钙(或S 、Ca) 。
(5) 溶液培养法(或无土栽培) 。
(6) 二氧化碳 。
31.(26分)
(Ⅰ)(12分,每空2分):
 (1)
(1)
。
(2)( D )
(3)① 单链 (或是合成蛋白质的模板)。
② 含有U(或尿嘧啶),不含T(胸腺嘧啶) 。
(4)( C )
(5) 1 。
(Ⅱ)(14分,每空2分)(1)___2___. (2) AaXBXb . _ AaXBY _。
(3) 1/ 3 , 5/24 . (4) B、E 、 C、F (两组答案不能互换)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com