
题目列表(包括答案和解析)
硫代硫酸钠(Na2S2O3)俗称保险粉,可用作定影剂,也可用于纸浆漂白、脱氯剂等。
Na2S2O3易溶于水,不溶于乙醇,常温下溶液中析出晶体通常为Na2S2O·5H2O。实验室制备保险粉的装置如下图所示。涉及的总化学方程式如下: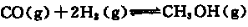
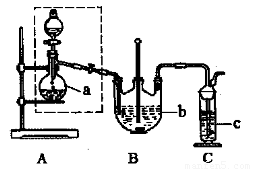
(1)检查虚线框内装置气密性的方法是? ????????????? 。
(2)反应前仪器a中加入的药品为???????? ,仪器c中加入的药品为 ?????????? 。
(3)仪器b的名称是?????????? 。
(4)在制备过程中,持续通人气体时,观察到B装置中先有大量浅黄色沉淀析出,反应一段时间,沉淀逐渐减少;待浅黄色沉淀消失时反应完成,停止加热。反应的离子方程式为??????? ???????????????? 。
(5)反应完成后,为了从混合溶液中获取产品,操作如下:
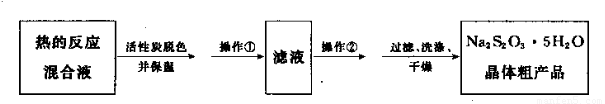
操作②为????????????? 。
(6)为了测产品的纯度,称取8.000 g粗产品,配制成250 mL溶液,用移液管移取25.00 mL于锥形瓶中,再用0.05000 mol·L-l的碘标准溶液进行滴定(2S2O32-+I2=S4O62-+2I-),
平行3次实验,平均消耗碘标准溶液的体积为30.00mL。
①测得产品的纯度为????????? 。
②关于上述实验的有关操作,以下表述正确的是 ??????????? 。(填编号)
A.用碱式滴定管盛装碘标准溶液
B.用移液管移取25.00mL溶液于锥形瓶中,移液管的尖嘴和锥形瓶内壁要接触
C.如果滴定终点没有控制好,碘标准溶液滴加过量,则必须重新进行滴定
D.滴定过程中若剧烈摇动锥形瓶(溶液不外溅),则所测得的纯度将会偏高
向某密闭容器中加入0.6 mol A、0.2 mol C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如甲图所示[其中t0-t1阶段c(B)未画出]。t2时刻后改变条件反应体系中反应速率随时间变化的情况如乙图所示,且四个阶段都各改变一种条件并且改变的条件均不相同。下列说法正确的是( )
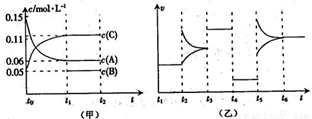
 A.反应的方程式为3A(g)+B(g)
2C(g)
A.反应的方程式为3A(g)+B(g)
2C(g)
B.t3~t4,t4~t5,t5~t6各阶段可能改变的条件依次为:加催化剂,降低反应温度,增大压强
C.B的起始物质的量为0.08 mol
D.若t1=10 s,A在t0~t1时间段的反应速率为0.00225 mol·L-1·s-1
____________________________________________________________。
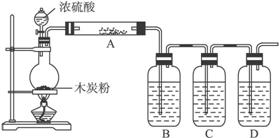
(2)上图装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,请写出还可以用什么简单的方法证明该装置不漏气:_________________________________。
(3)如果用图中的装置检验浓硫酸和木炭粉反应的全部产物,写出以下标号所表示的仪器中应加入的试剂的名称及其作用:
A中加入的试剂为____________,作用是______________________________。
B中加入的试剂为____________,作用是______________________________。
C中加入的试剂为____________,作用是除尽____________气体。
D中加入的试剂为____________,作用是______________________________。
(4)实验时,C中应观察到的现象是_________________________________________。
1.D 2.B 3.B 4.D 5.A 6.AD 7.D 8.AD 9.A 10.AC 11.AC
12.D 13.BC 14.D 15.C 16.D 17.A 18.B 19.A 20.A 21.C 22.D
23.(1)CuS、S (2)6∶1∶4
(3)

24.(1)D (2)> (3)B
25.解析:(1)
(2)因 中的
中的 ,
, 中的
中的 ,故依电子得失守恒有(x+1)×25.00×0.1000=5×30.00×0.0500,解之,x+2,即
,故依电子得失守恒有(x+1)×25.00×0.1000=5×30.00×0.0500,解之,x+2,即 被氧化成+2价氮的氧化物NO.又因V×C×2=30.00×0.0500×5,故
被氧化成+2价氮的氧化物NO.又因V×C×2=30.00×0.0500×5,故 .依题意知,
.依题意知,


 .所以
.所以 与
与 反应的方程式为
反应的方程式为

 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
26.解析:这是一道天平平衡问题的计算.两个烧杯的质量相等.两个烧杯里盐酸溶液的质量相等.因此论证天平两个烧杯内反应体系质量改变量相等是解决本题的关键.由题意可知:
 溶液增重
溶液增重
100 56
a
 溶液增重
溶液增重
84 40
x 40x/84
当0.3 mol HCl与 恰好完全反应时,消耗
恰好完全反应时,消耗 的质量为:
的质量为: 时;0.3 mol HCl与
时;0.3 mol HCl与 恰好完全反应,消耗
恰好完全反应,消耗 的质量为:0.3×84=
的质量为:0.3×84=
(1)a≤ 、
、 均过量,天平保持平衡的条件是:
均过量,天平保持平衡的条件是:
 x=
x=
(2)a> 不足,且对于
不足,且对于 恰好完全反应时,加入
恰好完全反应时,加入 的烧杯内反应体系的增重量为a-0.15×44,而加入
的烧杯内反应体系的增重量为a-0.15×44,而加入 的烧杯内反应体系的增重量为0.3×40.则天平保持平衡的条件是:
的烧杯内反应体系的增重量为0.3×40.则天平保持平衡的条件是:
a-0.15×44=0.3×40 a=18.6
因此,18.6≥a>15时,天平保持平衡的条件是:
 x=2,
x=2,
(3)当a>18.6时,天平保持平衡的条件是:a-0.15×44=x-0.3×44
x=a+6.6
因为烧杯中无固体剩余,说明a≤15. 、
、 的摩尔质量相当,当等质量的
的摩尔质量相当,当等质量的 、
、 与酸完全反应时,生成
与酸完全反应时,生成 质量相等.所以天平保持平衡时:x=a≤15
质量相等.所以天平保持平衡时:x=a≤15
27.解析:题中涉及化学反应如下: w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
 ①
①
 ②
②
 ③
③
(1)当剩余固体为 ,排出气体为
,排出气体为 、
、 时,因为没有NaOH生成,水未与
时,因为没有NaOH生成,水未与 反应.将方程式①×2+②得:
反应.将方程式①×2+②得:

由方程式可知: .
.
(2)当剩余固体为 、NaOH,排出气体为
、NaOH,排出气体为 、
、 时,由于有NaOH生成,所以有水与
时,由于有NaOH生成,所以有水与 反应.假设反应后无
反应.假设反应后无 生成,将方程式①×2+②+③得:
生成,将方程式①×2+②+③得:

由方程式可知此时 .因为有水生成,所以
.因为有水生成,所以
(3)当 时,由2讨论可知:剩余固体为
时,由2讨论可知:剩余固体为 、NaOH、
、NaOH、 ;排出气体为
;排出气体为 .
.
(4)当排出的 和
和 为等物质的量时,依方程式讨论有:
为等物质的量时,依方程式讨论有:

2b b b

b b 
设反应的 的物质的量为x
的物质的量为x

x x 
依题意有:

所以,反应中消耗 的物质的量为:
的物质的量为: ,用去
,用去 的物质的量为:
的物质的量为:
 w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
所以,
28.(1)0~50℃时, 不发生分解,固体物质质量不变
不发生分解,固体物质质量不变
(2)50℃~ 分解的结果,结晶水全部失去
分解的结果,结晶水全部失去

179 143

(3)100℃~ 稳定且不发生分解,故固体质量不变
稳定且不发生分解,故固体质量不变
(4)214℃~ 发生了分解
发生了分解

143 55+16x
0.80 0.40
x≈1 y=1.5,
故反应方程式为
(5)280℃~ 反应生成高价态氧化物
反应生成高价态氧化物
 方程式为
方程式为

29.解:假设反应后的混合物标况下仍为气体且体积为 ,由
,由 ,得
,得
 ,可见反应前后物质的量不变,设烷烃为
,可见反应前后物质的量不变,设烷烃为 ,体积为x,则CO为
,体积为x,则CO为
由 体积减少
体积减少

 体积增加
体积增加
 nL (n+1)L
nL (n+1)L 
x

据题意得: nx=
nx=
讨论:(1)n=l时,x=
(2)n=2时,
(3)n=3时,
(4)n=4时,
(5)n≥5时,常温下烷烃不是气态,所以,烷烃可能是 占50%或是:
占50%或是: 占33.3%或:
占33.3%或: 占25%
占25% w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
30.(1)

2 mol 2 mol 2 mol 2 mol
溶液中剩余的水的质量为:
析出小苏打的质量为:
(2) 和
和
当降温至 的质量为:
的质量为:

析出 的质量为:
的质量为:
 共析出晶体的质量为:
共析出晶体的质量为: www.ks5u.com
www.ks5u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com