
题目列表(包括答案和解析)
接触法制硫酸排放的尾气中含少量的二氧化硫,为防止污染大气,在排 放前要进行综合利用。
(1)某硫酸厂每天排放的10000m3尾气中含0.2%(体积分数)的SO2。问:用氢氧 化钠溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到多少千克石膏(CaSO4·2H2O)?(2)如果将一定体积的尾气通入100mL 2mo1·L-1的氢氧化钠溶液使其完全反应,经 测定所得溶液16.7g溶质。试分析该溶液的成分,并计算确定各成分的物质的量。
(3)工厂在尾气处理制石膏的过程中,中间产物是亚硫酸氢钠。调节尾气排放的流量,以取得二氧化硫与氢氧化钠物质的量的最佳比值,从而提高亚硫酸氢钠的产量。现设 n(SO2)/n(NaOH)、n(NaHSO3)分别表示二氧化硫、氢氧化钠和亚硫酸氢钠的物 质的量,且n(SO2)/n(NaOH)=X,试写出X在不同取值范围时,n(NaHSO3)、 n(SO3)、n(NaOH)间的关系式。
(1)某硫酸厂每天排放的10000m3尾气中含0.2%(体积分数)的SO2。问:用氢氧 化钠溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到多少千克石膏(CaSO4·2H2O)?(2)如果将一定体积的尾气通入100mL 2mo1·L-1的氢氧化钠溶液使其完全反应,经 测定所得溶液16.7g溶质。试分析该溶液的成分,并计算确定各成分的物质的量。
(3)工厂在尾气处理制石膏的过程中,中间产物是亚硫酸氢钠。调节尾气排放的流量,以取得二氧化硫与氢氧化钠物质的量的最佳比值,从而提高亚硫酸氢钠的产量。现设 n(SO2)/n(NaOH)、n(NaHSO3)分别表示二氧化硫、氢氧化钠和亚硫酸氢钠的物 质的量,且n(SO2)/n(NaOH)=X,试写出X在不同取值范围时,n(NaHSO3)、 n(SO3)、n(NaOH)间的关系式。
接触法制H2SO4的基本原理是:
①4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
②2SO2+O2 ![]() 2SO3
2SO3
③SO3+H2O ![]() H2SO4
H2SO4
其中排放的尾气含少量SO2,为防止污染大气,在排放前应设法进行综合利用。
(1)某硫酸厂每天排放10000m3(换算成标准状况下体积)尾气中含0.2%(体积分数)的SO2,问用NaOH溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到多少千克石膏(CaSO4·2H2O)?
(2)如果将一定体积的尾气通入100mL2mol·L-1的NaOH溶液使其完全反应,经测定所得溶液含16.7g溶质。试分析溶液的成分,并计算各成分的物质的量。
(3)工厂在尾气处理制石膏的过程中,中间产物是NaHSO3,调节尾气排放的流量,以取得SO2和NaOH间物质的量的最佳比值,从而提高NaHSO3的产量。现设n(SO2)、n(NaOH)、n(NaHSO3)分别表示SO2、NaOH、NaHSO3的物质的量,且![]() =x,试写出x在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系式。
=x,试写出x在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系式。
| x=n(SO2)/n(NaOH) | n(NaHSO3) |
提示:该题取材于接触法制硫酸的过程中对废气SO2的处理,即消除了SO2对空气的污染,又使SO2得到综合利用。该题在能力要求上有一定的深度和坡度。第(1)步考查多步反应的计算,所发生的一系列反应较为复杂,但根据S元素守恒找出关系式,即可得出答案。第(2)步涉及平行反应中混合物的计算。反应方程式为2NaOH+SO2 ![]() Na2SO3+H2O;NaOH+SO2
Na2SO3+H2O;NaOH+SO2 ![]() aHSO3。根据题给条件,对上述反应运用极值假设法进行分析讨论。第(3)步考查计算题中范围讨论的基础知识,以及过量问题和平行反应的计算。
aHSO3。根据题给条件,对上述反应运用极值假设法进行分析讨论。第(3)步考查计算题中范围讨论的基础知识,以及过量问题和平行反应的计算。
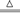 2Fe2O3+8SO2
2Fe2O3+8SO2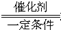 2SO3
2SO3 H2SO4
H2SO4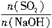 =x,试写出x在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系式。
=x,试写出x在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系式。| x=n(SO2)/n(NaOH) | n(NaHSO3) |
| | |
| | |
| | |
 Na2SO3+H2O;NaOH+SO2
Na2SO3+H2O;NaOH+SO2  aHSO3。根据题给条件,对上述反应运用极值假设法进行分析讨论。第(3)步考查计算题中范围讨论的基础知识,以及过量问题和平行反应的计算。
aHSO3。根据题给条件,对上述反应运用极值假设法进行分析讨论。第(3)步考查计算题中范围讨论的基础知识,以及过量问题和平行反应的计算。巩固:1、C 2、C 3、8.42% 4、B 5、BC 6、8.5ml,12ml
随堂作业: 1、BD 2、B 3、D 4、A 5、B 6、C 7、C 8、B 9、D 10、C
11、 (1)当完全反应时,nH2为2(a-b)mol,nO2为(a-b)mol;
(2)当H2有剩余时,nH2为bmol,nO2为 (a-b)mol;
(3)当O2有剩余时,nH2为2(a-b)mol,nO2为(2b-a)mol。]
12、(1)NH3+2O2=HNO3+H2O
O
<X<1
nNaHSO3=2nSO2-nNaOH
X≥1
nNaHSO3=nNaOH
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com