
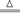 2Fe2O3+8SO2
2Fe2O3+8SO2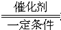 2SO3
2SO3 H2SO4
H2SO4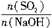 =x,试写出x在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系式。
=x,试写出x在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系式。| x=n(SO2)/n(NaOH) | n(NaHSO3) |
| | |
| | |
| | |
 Na2SO3+H2O;NaOH+SO2
Na2SO3+H2O;NaOH+SO2  aHSO3。根据题给条件,对上述反应运用极值假设法进行分析讨论。第(3)步考查计算题中范围讨论的基础知识,以及过量问题和平行反应的计算。
aHSO3。根据题给条件,对上述反应运用极值假设法进行分析讨论。第(3)步考查计算题中范围讨论的基础知识,以及过量问题和平行反应的计算。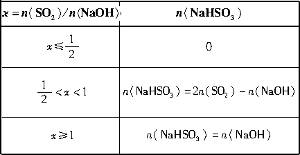
 Na2SO3+H2O
Na2SO3+H2O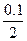 mol=12.6g
mol=12.6g NaHSO3
NaHSO3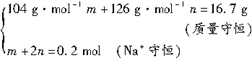
 nNa2SO3+mNaHSO3+nH2O
nNa2SO3+mNaHSO3+nH2O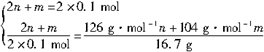
 Na2SO3+H2O(Ⅰ)
Na2SO3+H2O(Ⅰ) NaHSO3(Ⅱ)
NaHSO3(Ⅱ)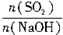 ≤
≤ 时,反应按(Ⅰ)式进行,SO2全部反应,生成物皆为Na2SO3,故n(NaHSO3)=0。
时,反应按(Ⅰ)式进行,SO2全部反应,生成物皆为Na2SO3,故n(NaHSO3)=0。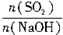 ≥1时,反应按(Ⅱ)式进行,NaOH全部反应,生成物全是NaHSO3,有n(NaHSO3)=n(NaOH)。
≥1时,反应按(Ⅱ)式进行,NaOH全部反应,生成物全是NaHSO3,有n(NaHSO3)=n(NaOH)。 <x<1时,(Ⅰ)(Ⅱ)两个反应平行进行,NaOH与SO2两物质均耗尽,生成NaHSO3和Na2SO3的混合物。〔由(2)步的分析可有〕
<x<1时,(Ⅰ)(Ⅱ)两个反应平行进行,NaOH与SO2两物质均耗尽,生成NaHSO3和Na2SO3的混合物。〔由(2)步的分析可有〕

 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源:不详 题型:判断题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.红色先加深后褪至无色 | B.红色立刻褪去,溶液变为无色 |
| C.红色加深,颜色不褪 | D.红色既不加深也不褪去 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
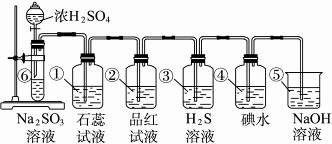
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 )溶液颜色褪去的是 ;
)溶液颜色褪去的是 ;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com