Ⅰ海水中蕴藏着丰富的资源.海水综合利用的流程图如下.
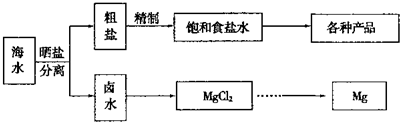
用NaCl做原料可以得到多种产品.
①工业上由NaCl制备金属钠的化学方程式是
.
②实验室用惰性电极电解500mL0.1mol/LNaCl溶液,若阴阳两极共得到112mL气体(标准状况),则所得溶液的pH为
12
12
(忽略反应前后溶液的体积变化)
③电解NaCl稀溶液可制备“84消毒液”,通电时产生的氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出该电解的总化学方程式:
.
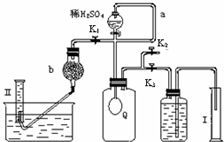
Ⅱ铝粉是铝热剂的主要成份之一,常用铝锭制得的铝粉中含有少量的Al
2O
3和SiO
2,用如图所示的装置(甲、乙管用橡皮管连接可上下移动)测定铝粉中金属铝的含量,其方法是:用稀硫酸或氢氧化钠溶液与样品作用,通过产生的气体体积计算样品中金属铝的含量,根据实验原理回答下列问题:
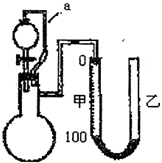
(1)装置中导管a所起的作用是
平衡气压,使分液漏斗中的液体顺利滴下
平衡气压,使分液漏斗中的液体顺利滴下
.
(2)为了较准确测量产生的气体体积,在反应前后读取甲管液面的读数时应注意
AD
AD
.
A.反应前后读取甲管液面数据时应使甲、乙中液面保持水平
B.反应后读取甲管液面数据时,甲、乙两管液面无须保持水平
C.反应后立即读取甲管液面数据,防止液面变动
D.反应后静置一会,需待反应器恢复原来温度
(3)若从稀硫酸和氢氧化钠溶液中挑选一种试剂,你选择的试剂是
NaOH溶液
NaOH溶液
,不选择另一种试剂的理由是
由于样品中含有SiO2,不与硫酸反应,有部分铝可能会包裹在SiO2中,不能确定铝是否反应完全,使实验结果产生一定误差
由于样品中含有SiO2,不与硫酸反应,有部分铝可能会包裹在SiO2中,不能确定铝是否反应完全,使实验结果产生一定误差
.




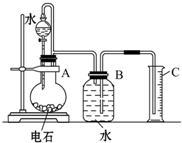 某同学设计了如图所示的实验装置来粗略地测定电石中碳化钙的质量分数.
某同学设计了如图所示的实验装置来粗略地测定电石中碳化钙的质量分数.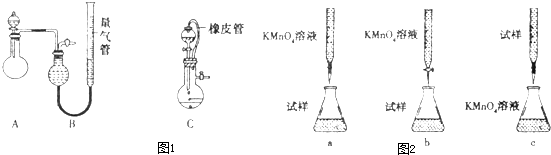
 过碳酸钠(Na2CO4)在洗涤、印染、造纸、医药卫生等领域有大量应用.
过碳酸钠(Na2CO4)在洗涤、印染、造纸、医药卫生等领域有大量应用.