
题目列表(包括答案和解析)
 下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B,C,D,E是非金属单质,且在常温下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应.请回答下列问题:
下图是部分短周期元素的单质及其化合物(或其溶液)的转化关系,已知B,C,D,E是非金属单质,且在常温下都是气体;化合物G的焰色反应为黄色,化合物I和J通常状况下呈气态;反应①是化工生产中的一种重要固氮反应.请回答下列问题:

| ||
| 高温高压 |
| ||
| 高温高压 |
 下图是部分短周期元素的常见化合价与原子序数的关系图,下列说法正确的是( )
下图是部分短周期元素的常见化合价与原子序数的关系图,下列说法正确的是( )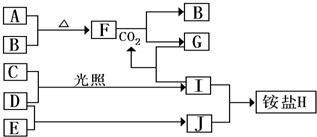
下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。下列说法正确的是

A.X和R在同一周期
B.原子半径:W>R>X
C.气态氢化物的稳定性:Y>X
D.X、Z形成的化合物中可能含有共价键
下图是部分短周期元素的常见化合价与原子序数的关系图:
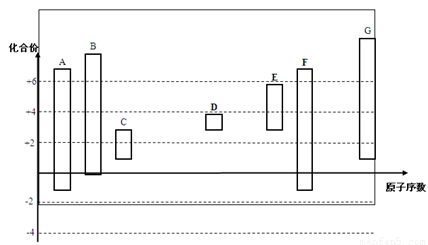
(1)元素A在周期表中的位置 。
(2)用电子式表示D2G的形成过程 其所含化学键类型为 。
(3)C2-、D+、G2-离子半径大小顺序是 > > (用离子符号回答)
(4)某同学设计实验证明A、B、F的非金属性强弱关系。

① 溶液a和b分别为 , 。
② 溶液c中的离子方程式为 。
③ 请从原子结构的角度解释非金属性B > A的原因 。
(5)将0.5 mol D2C2投入100 mL 3 mol/L ECl3溶液中
① 转移电子的物质的量为 。
② 用一个离子方程式表示该反应 。
1B
3D
5D
10BC
12AD
13BD
14BC
15.(12分)(1)x=1.5 (2)c(3)2Na2CO4=2Na2CO3+O2↑
(4)2CO42-+4H+=2CO2↑+O2↑+H2O
(5)g→h→e→f→d→c→b,
16.(8分)(1)CO(NH2)2 (2)AlO2-+CO2+H2O==Al(OH)3↓+HCO3-
(3)2Al2O3+2N2+
(4)CO2在水中的溶解度远小于NH3,若先通入CO2,则反应③中K的产率很低
17.(12分)(1)①(1分) (2)①②⑤(2分)
NO+NO2+2NaOH=2NaNO2+H2O(1分) 88.5%(2分)
(3)4FeS2+15O2+2H2O 2Fe2(SO4)3+2H2SO4(2分)
2Fe2(SO4)3+2H2SO4(2分)
Cu2S+10Fe3++4H2O 2Cu2++10Fe2++8H++SO42-(2分)
2Cu2++10Fe2++8H++SO42-(2分)
(4)3NO=N2O十NO2(1分),由于2NO2 N2O4,即生成的NO2又双聚成N2O4,导致气体分子数减少,使其压强路小于1.01×107 Pa的2/3(1分)
N2O4,即生成的NO2又双聚成N2O4,导致气体分子数减少,使其压强路小于1.01×107 Pa的2/3(1分)
18.(10分)(1)ABEF(2分)
(2)c(SO42-)>c(Fe2+)>c(H+)>c(OH-) (2分)
(3)硫酸作用Fe2+抑制的水解,铁皮的作用防止Fe3+的氧化。(2分,各1分)
(4)在试管中取滤液少许,加入足量的NaOH溶液,加热,用湿润的红色石蕊试纸检验,若试纸变兰色,则证明滤液中含有NH4+。(2分)
(5)FeSO4+2NH4HCO3 →FeCO3↓+( NH4)2 SO4+ CO2↑+H2O(2分)
19. (12分)(1)F: I:  (2分)(2)加成、消去 (2分)
(2分)(2)加成、消去 (2分)
 |
(4)4 (2分)
(5)
 |
20(8分)(1)Cu+2H++H2O2==Cu2++2H2O (2分) (2) 淀粉溶液为指示剂,当最后一滴Na2S2O3溶液滴入时,溶液蓝色褪去。(2分)
(3)n(Cu)=1/2n(I2) = n(S2O32-)=6.45×0.01100=0.07095mmol
ωCu=0.07095×10-3×64×250.00/50.00/1.1=0.02064(4分)
21.(10分)(5)2分,其它每空1分
(1)Ar (2)极性 (3)5 1 (4)D是CH3OH,分子之间能形成氢键
(5)CO中第一个π键的键能是273kJ/mol,N2中第一个π键的键能是523.3kJ/mol,所以CO的第一个键比N2更容易断。
(6)1s22s22p63s23p6 3d104s1
(7)分子晶体
www.ks5u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com