
2.(03年江苏高考题)若以ω1和ω2分别表示浓度为a mol?L-1和b mol?L-1氨水的质量分数,且知2a=b,则下列推断正确的是(氨水的密度比纯水的小)( )
A 2ω1=ω2 B 2ω2=ω1 C ω2>2ω1 D ω1<ω2<2ω1
思维方法: 。
【课堂练习】绿色通道
【课外作业】绿色通道
第八讲 有关物质的量的计算
【考纲要求】
A
 B
B 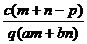 C
C  D
D 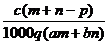
思维方法: 。
1.(03年江苏高考题)质量分数为a的某物质的溶液mg与质量分数为b的该物质的溶液ng混合后,蒸发掉pg水,得到的溶液每毫升质量为qg,物质的量浓度为c。则溶质的分子量(相对分子质量)为( )
C.小于9.2mol?L―1 D.不能确定
解题思路: 。
易错点: 。
【考题再现】
A.等于9.2mol?L―1 B.大于9.2mol?L―1
[例2 ]已知98%的浓H2SO4的浓度为18.4mol? L―l,则49%的硫酸溶液的浓度为 ( )

A.1000d×A%=C×M B.
C.S=100W/1000V D.A%=W/(W+1000V)%]
解题思路: 。
易错点: 。
2.c、 %、ρ之间的计算关系
%、ρ之间的计算关系 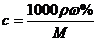
物理量
质量分数
物质的量浓度
溶解度
溶质单位
溶液单位
单 位
数值上关系
质量分数相同的两溶液其物质的量浓度一般 等.
物质的量浓度相同的两溶液其质量分数一般 等.
溶质溶解度相同的两溶液其在同一温度下饱和溶液的质量分数 等.
定 义
符号
表达式
相同点
都能示溶质和溶液的相对比值
转化关系
四、溶液的稀释
(1)溶液的稀释:
①V1p1×W1%= V2p2×W2% 或W液×W1%=(W液+W水)×W2%(溶质的质量守恒)
②C1V1=C2V2(溶质的物质的量守恒)
(2)溶液混合:C V=C2V2+C1V1(溶质的质量守恒)。
【教学过程】见ppt文件
【例题解析】
[例1]某无水易溶盐X,摩尔质量为M g/mol,其溶解度为Sg.取其Wg加入VL
蒸馏水,配制成密度为d g/mL,质量百分浓度为A%,物质的量浓度为Cmol/L的澄
清溶液.下式表示正确的是
1.物质的量浓度的计算

2. 物质的量浓度溶液的配制
(1) 容量瓶
①特点:
②用途: 。容量瓶有各种不同规格,
常用的规格有100mL、250mL、500mL和1000mL等。
(2)配制一定体积物质的量浓度溶液的步骤及所用仪器如下:
(3)配制物质的量浓度溶液时,应注意的问题:
。
二、计算公式
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com