
1、知识与技能
(1)知道物质是由大量分子组成的,组成物质的分子有一定大小和质量,知道阿伏伽德罗数,能用实验说明分子动理论的基本观点。
(2)知道大量偶然事件的整体表现所显示的规律叫统计规律,知道大量分子的速率分布具有统计规律。
(3)学会用油膜法估测分子的大小。
从本节开始把对物质运动的研究从宏观物体深入到微观结构的领域,从而使学生对物质世界的认识进一步深化了,统计方法的介绍又使学生首次认识到一种新的研究方法,我们知道宏观热现象的本质是微观的热运动,因此本节内容是学生认识热现象本质的基础。
总的来说,由于本节内容是一个新知识领域中的基础内容,因此学生不可能以同化的方式来学习,将新知识纳入已有的认知结构,本节内容的学习以观察、实验为基础,以假设推理为纽带,从而构建起新的知识。化学课中学过的“摩尔”及“阿伏伽德罗数”将有助于本节的学习。
以演示热气球上升为情景引入课题,主要在“用油膜法估测分子的大小”的自主实验、“墨水扩散”的演示实验和“反映分子力”的自主实验的基础上建立起分子动理论的基本内容,最后以“伽耳顿板”演示实验和课前的“投掷硬币”自主实验为基础介绍分子速率的统计规律性。
在“用油膜法估测分子的大小”的自主性实验中由于学生要构建“单分子油膜层”的模型,这将使学生体验到“建模”方法的重要性,本实验还以增强学生仔细观察、认真操作、乐于交流的态度,并从中领略科学家利用宏观的测量方法来探测微观世界的精妙。“抛硬币”实验和“伽耳顿板”实验将使学生认识统计学的研究方法。
5、原子晶体熔、沸点比较规律
对于原子晶体,一般来说,原子间键长越短,键能越大,共价键越稳定,物质的熔沸点越高,硬度越大。
[比较归纳]原子晶体与分子晶体的比较
|
|
分子晶体 |
原子晶体 |
|
构成微粒 |
分子 |
原子 |
|
晶体内相互作用力 |
分子间作用力(含极性、氢键) |
共价键 |
|
硬度、熔沸点 |
低 |
高 |
|
熔、沸点变化规律 |
(1)对于组成结构相似的物质,相对分子质量(2)极性分子非极性分子(3)氢键作用 |
键长、键能 |
|
化学式能否表示分子结构 |
能 |
不能 |
[总结]非金属单质是原子晶体还是分子晶体的判断方法
(1)依据组成晶体的粒子和粒子间的作用判断:原子晶体的粒子是原子,质点间的作用是共价键;分子晶体的粒子是分子,质点间的作用是范德华力。
(2)记忆常见的、典型的原子晶体。
(3)依据晶体的熔点判断:原子晶体熔、沸点高,常在1000℃以上;分子晶体熔、沸点低,常在数百度以下至很低的温度。
(4)依据导电性判断:分子晶体为非导体,但部分分子晶体溶于水后能导电;原子晶体多数为非导体,但晶体硅、晶体锗是半导体。
(5)依据硬度和机械性能判断:原子晶体硬度大,分子晶体硬度小且较脆。
4、原子晶体的结构
(1)金刚石晶体
①金刚石中每个C原子以sp3杂化,分别与4个相邻的C 原子形成4个σ键,故键角为109°28′,每个C原子的配位数为4;
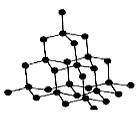
②每个C原子均可与相邻的4个C构成实心的正四面体,向空间无限延伸得到立体网状的金刚石晶体,在一个小正四面体中平均含有1+4×1/4 =2个碳原子;
③在金刚石中最小的环是六元环,1个环中平均含有6×1/12=1/2个C原子,含C-C键数为6×1/6=1;
④金刚石的晶胞中含有C原子为8个,内含4个小正四面体,含有C-C键数为16。
(2)二氧化硅晶体
①二氧化硅中Si原子均以sp3杂化,分别与4个O原子成键,每个O原子与2个Si原子成键;
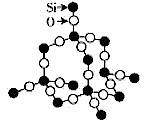
②晶体中的最小环为十二元环,其中有6个Si原子和6个O原子,含有12个Si-O键;每个Si原子被12个十二元环共有,每个O原子被6个十二元环共有,每个Si-O键被6个十二元环共有;每个十二元环所拥有的Si原子数为6×1/6=1,拥有的O原子数为6×1/6=1,拥有的Si-O键数为12×1/6=2,则Si原子数与O原子数之比为1:2。
[思考6]原子晶体的化学式是否可以代表其分子式?
不能。因为原子晶体是一个三维的网状结构,无小分子存在。
[思考7]以金刚石为例,说明原子晶体的微观结构与分子晶体有哪些不同?
(1)组成微粒不同,原子晶体中只存在原子,没有分子。
(2)相互作用不同,原子晶体中存在的是共价键。
3、原子晶体的物理特性

在原子晶体中,由于原子间以较强的共价键相结合,而且形成空间立体网状结构,所以原子晶体具有:
(1)熔点和沸点高;
(2)硬度大;
(3)一般不导电;
(4)且难溶于一些常见的溶剂。
[思考4]为何CO2熔沸点低?而破坏CO2分子却比SiO2更难?
因为CO2是分子晶体,SiO2是原子晶体,所以熔化时CO2是破坏范德华力而SiO2是破坏化学键。所以SiO2熔沸点高。破坏CO2分子与SiO2时,都是破坏共价键,而C-O键能>Si-O键能,所以CO2分子更稳定。
[思考5]怎样从原子结构角度理解金刚石、碳化硅和锗的熔点和硬度依次下降?
因为结构相似的原子晶体,原子半径越小,键长越短,键能越大,晶体熔点越高,所以熔点和硬度有如下关系:金刚石>碳化硅>锗。
2、常见的原子晶体
(1)某些非金属单质:金刚石(C)、晶体硅(Si)、晶体硼(B)、晶体锗(Ge)等。
(2)某些非金属化合物:碳化硅(SiC)晶体、氮化硼(BN)晶体等。
(3)某些氧化物:二氧化硅(SiO2)晶体。
1、定义:相邻原子间以共价键相结合而形成空间立体网状结构的晶体。
(1)构成原子晶体的粒子是原子;
(2)原子晶体的粒子间以较强的共价键相结合;
(3)原子晶体熔化破坏的是共价键。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com