
3.某合作学习小组讨论辨析以下说法:①粗盐和酸雨都是混合物; ②沼气和水蒸气都是可再生能源; ③可用丁达尔现象区分溶液与胶体 ④不锈钢和目前流通的硬币都是合金; ⑤盐酸和食醋既是化合物又是酸; ⑥Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到; ⑦小苏打是一种膨松剂,可用于制作馒头和面包. 上述说法正确的是 ..... ( )
A.①②③④ B.①②⑤⑥ C.③⑤⑥⑦ D.①③④⑦
2.下列离子方程式书写正确的是 ( )
A.用铂电极电解氯化镁溶液:Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B.NaHSO4溶液中滴入Ba(OH)2溶液至中性:H++SO42-+Ba2+十OH-===BaSO4↓+H2O
C.在H2O2中加入酸性KMnO4溶液:2MnO4-+5H2O2+6H+====2Mn2+ +5O2↑+8H2O
D.溴乙烷与6mol/L氢氧化钠水溶液共热:C2H5Br
+OH-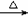 CH2=CH2↑+Br-+H2O
CH2=CH2↑+Br-+H2O
1.某溶液中加入铝粉能产生氢气,在该溶液中一定能大量共存的离子组是 ( )
A.Na+、K+、Cl-、SO42- B.Cu2+、Fe2+、NO3-、SO42-
C.Na+、Ca2+、Cl-、ClO- D.K+、NH4+、Cl-、SO42-
3、298K,101kPa时,合成氨反应的热化学方程式N2(g)+3H2(g)=2NH3(g);△H= -92.38kJ/mol。 在该温度下,取1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在进行反应,测得反应放出的热量总是少于92.38kJ,其原因是什么。
4.例题
1)同素异形体相互转化但反应热相当小而且转化速率慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的观点“不管化学反应是一步完成或分几步完成,这个总过程的热效应是相同的”。已知P4(s、白磷)+5O2(g)=P4O10(s);ΔH = -2983.2 kJ/mol
P(s、红磷)+5/4O2(g)=1/4P4O10(s);ΔH = -738.5 kJ/mol
试写出白磷转化为红磷的热化学方程式
_________________________________。
2)在同温同压下,下列各组热化学方程式中Q2>Q1的是(B )
A.H2(g)+Cl2(g)=2HCl(g);△H=-Q1
1/2H2(g)+1/2Cl2(g)=HCl(g);△H =-Q2
B.C(s)+1/2O2(g)=CO (g); △H= -Q1
C(s)+O2(g)=CO2 (g); △H= -Q2
C.2H2(g)+O2(g)=2H2O(l); △H= -Q1
2H2(g)+O2(g)=2H2O(g); △H= -Q2
D. S(g)+O2(g)=SO2 (g); △H= -Q1
S(s)+O2(g)=SO2 (g); △H= -Q2
3.如何理解盖斯定律?
1)请用自己的话描述一下盖斯定律。
2)盖斯定律有哪些用途?
2.盖斯定律:
不管化学反应是分一步完成或分几步完成,其反应热是相同的。化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
1.引入:如何测出这个反应的反应热:C(s)+1/2O2(g)==CO(g)
①C(s)+1/2O2(g)==CO(g) ΔH1=?
②CO(g)+1/2O2(g)== CO2(g) ΔH2=-283.0kJ/mol
③C(s)+O2(g)==CO2(g) ΔH3=-393.5kJ/mol
① + ② = ③ ,则 ΔH1 + ΔH2 =ΔH3所以,ΔH1=ΔH3-ΔH2 ΔH1=-393.5kJ/mol+ 283.0kJ/mol=-110.5kJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com