
48. (7)< (8)= (9)II (10)50
47.(1)钙 (2)碱性 (3)吸附 (4)盐 (5)75%或0.75或3/4 (6)>
27. A 28.B 29.A 30.C 31.A 32.B 33.B 34.D 35.D 36.A 37.B 38.C 39.C 40.D 41.B 42.A 43.C 44.C 45.D 46.D
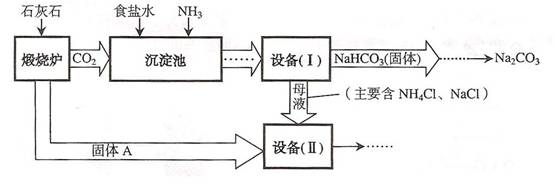
54. 工业上可以用食盐和石灰石为原料制取纯碱(Na2CO3),生产的关键是在沉淀池中让 NaCl、NH3、CO2和H2O尽可能多地转化成NaHCO3(固体沉淀物)和NH4Cl(溶液)。主要生产流程如下:
工业上可以用食盐和石灰石为原料制取纯碱(Na2CO3),生产的关键是在沉淀池中让 NaCl、NH3、CO2和H2O尽可能多地转化成NaHCO3(固体沉淀物)和NH4Cl(溶液)。主要生产流程如下:
(已知2NH4CI+Ca(OH)2 CaCl2+2NH3 ↑+2H2O)
CaCl2+2NH3 ↑+2H2O)
① “煅烧炉”中发生反应的化学方程式是 (11) 。
② 若在化学实验室里分离“设备(I)”中的混合物,用到的操作名称是 (12) 。
③ 在“设备(Ⅱ)”中固体A与水反应的化学方程式是 (13) 。
该反应属于 (14) 反应(填写基本反应类型)。
④ 对“设备(Ⅱ)”中的母液处理后,除水以外可在本流程中再利用的物质有
(15) (填写化学式)。
⑤ 请写出一个该生产流程的优点: (16) 。
理化试卷答案及评分标准
化学部分
53.为了探究氧化铜与碳反应生成的气体产物,甲同学设计并进行了如下实验:取一定量
氧化铜和碳的混合粉末,在不含氧气的高温条件下反应,将生成的气体通入澄清石灰水,
发现石灰水变浑浊。由此得出结论,生成的气体产物一定是CO2。
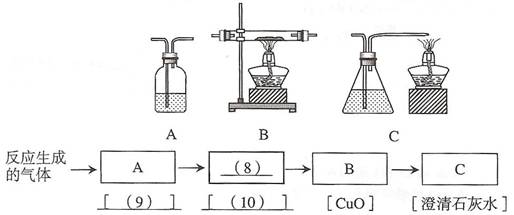
① 甲同学加热混合粉末时观察到的现象是:黑色粉末 (5) 。
② 澄清石灰水变浑浊时发生反应的化学方程式是 (6) 。
③ 检验气体产物是CO2的另一种方法是:将生成的气体通入石蕊溶液中,溶液变
(7) 色。
④ 乙同学认为,甲同学的实验不能证明反应的气体产物只有CO2,乙同学推测气体产
物中可能还有CO。请你从下列A、B、C中选择实验装置,用于验证乙同学的推测。将所选装置的编号填入方框,并在方括号内写出相应装置内盛放的化学试剂。
52.为了得到3.3mol氢气,实验室取用1000 mL某浓度盐酸(密度为1.1g/mL)与足量的
锌粒完全反应。
① 盐酸含HCl的物质的量是多少?(根据化学方程式列式计算)
② 上述盐酸中HCl的质量分数为 (4) 。(保留l位小数)
请根据要求在答题纸相应的位置作答。
51.固体A中可能含有Na2SO4、CuSO4、Na2CO3、KNO3中的一种或几种,进行如下实验,
观察、记录现象,并逐步推出结论。请完成下表:
|
实验步骤及现象 |
结论 |
|
①
将少许A溶于水得到无色溶液B。 |
A中一定没有 (1) |
|
②
在B中加入足量BaCl2溶液,生成白色沉淀。 |
A中一定有 (2) |
|
③
在白色沉淀中加入足量稀盐酸,沉淀部分溶解。 |
|
|
④
另取少许A进行焰色反应,透过蓝色钴玻璃片, 观察到火 焰呈 (3) 色。 |
A中还有KNO3 |
50.① 荷兰科学家启普(Kipp)发明的气体发生器如图(甲、乙),其中正在产生气体的
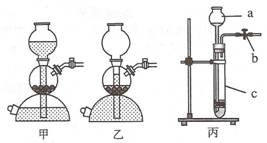 是 (14) (填写“甲”或“乙”)。
是 (14) (填写“甲”或“乙”)。
② 图丙是一种简易启普发生器。
请写出:
I.仪器a和c的名称:
a (15) ,c (16) 。
II.实验室用丙可制取CO2气体,反应
的化学方程式是 (17) 。
Ⅲ.若收集了一定量气体后夹紧b,c内反应物固体与液体无法分开,可能有哪些原因?
(18) 。
49.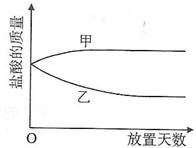 将一定质量的浓盐酸盛于烧杯中,敞口放置在实验室安全之处。
将一定质量的浓盐酸盛于烧杯中,敞口放置在实验室安全之处。
① 浓盐酸的质量和放置天数关系的曲线(见右图)正确
的是 (11) (填写“甲”或“乙“)。
② 随着放置天数的增加,浓盐酸的质量发生变化的主要
原因是________ (12)_____ ______。
③ 把浓盐酸稀释后可用于去除铁制品表面的铁锈(主要
成分为Fe2O3),反应的化学方程式是 (13) 。
48. 右图表示A、B两种物质溶解度(s)随温度(r)的变化,请回答:
右图表示A、B两种物质溶解度(s)随温度(r)的变化,请回答:
① 在t1℃时,S(A) (7) S(B);在t2℃时,S(A) (8) S(B)
(以上两空均填写“>”、“<”或“=”)。
② 从B的饱和溶液中提取B,应采用的方法是 (9) (填写编号)。
I.冷却结晶 II.蒸发溶剂 III.过滤
③ t3℃时,要完全溶解40gA得到饱和溶液,需要水 (10) g。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com