
4.由1,3,5,…,2n-1,…构成数列{an},数列{bn}满足b1=2,当n≥2时,bn=abn-1,则b5等于
( )
A.63 B.33
C.17 D.15
[解析] 由题知:an=2n-1,且b1=2,故b2=ab1=a2
=2×2-1=3;b3=ab2=a3=2×3-1=5;b4=ab3=a5=2×5-1=9;b5=ab4=a9=2×9-1=17, 故选C.
[答案] C
3.已知数列{an}的前n项和Sn=n2-9n,第k项满足5<ak<8,则k等于
( )
A.9 B.8
C.7 D.6
[解析] ∵Sn=n2-9n
∴n≥2时an=Sn-Sn-1=2n-10
a1=S1=-8适合上式∴an=2n-10(n∈N*)
∴5<2k-10<8,得7.5<k<9,∴k=8.
[答案] B
2.在数列{an}中,a1=1,anan-1=an-1+(-1)n(n≥2,n∈N*),则的值是
( )
A. B.
C. D.
[解析] 由已知得a2=1+(-1)2=2,
∴a3·a2=a2+(-1)3,∴a3=,
∴a4=+(-1)4,∴a4=3,
∴3a5=3+(-1)5,∴a5=,
∴=×=.
[答案] C
1.数列-1,7,-13,19,…的通项公式an为
( )
A.2n-1 B.-6n+5
C.(-1)n6n-5 D.(-1)n(6n-5)
[解析] 解法1:先看各项的绝对值组成的数列为1,7,13,19…是首项为1、公差为6的等差数列,即有|an|=|6n-5|,再看符号:奇数项为负,偶数项为正即为(-1)n,
故有an=(-1)n(6n-5).
解法2:特殊值代入验证.
[答案] D
4.6g n(NaOH) V(H2)
V(H2)=== 2.24L n(NaOH)== 0.2 mol
(2)所得溶液溶质的物质的量浓度是多少?
解:由上 n(NaOH)== 0.2 mol
C(NaOH)=== n / v === 0.2 mol / 0.1 L === 0.2 mol / L
21.(6分)取4.6克的钠投入水中,完全反应后,溶液的体积为1L,请列式计算:
(1)生成的气体体积在标准状况下为多少升?
解: 2Na + 2H2O === 2NaOH + H2 ↑
46g 2mol 22.4L
20.(17分)按要求填空(1)若某药品质量为32.0g,用托盘天平准确称其质量(游码刻度0--5.0g),若用↓表示向右盘放上砝码,用↑表示将砝码取下。在下列表格的空格内,用↓和↑表示相应砝码的放上或取下。(2分)
|
50g |
20g |
20g |
10g |
5g |
游码 |
|
↓↑ |
↓ |
↓↑ |
↓ |
↓↑ |
2.0
g |
(2)配制500mL 0.1mol·L -1 Na2CO3溶液,下图操作②中应该填写的数据为 5.3g ,实验时下图所示操作的先后顺序为 ②④③⑤①⑥ (填编号)。(4分)

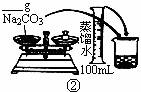



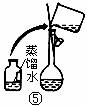

(3)在配制一定量的物质的量浓度溶液时,用“偏高、偏低、无影响”表示下列操作对所
配溶液浓度的影响。(3x2分)
①定容时俯视,所配制溶液的浓度 偏高 。
②容量瓶洗涤后未干燥,所配制溶液的浓度 无影响 。
③转移溶液时温度未冷却到室温,所配制溶液的浓度 偏高 。
(4)若将少量碳酸钠固体,放入稀盐酸中,现象: 有无色气泡冒出 ,
反应的方程式为 Na2CO3 + 2 HCl === 2 NaCl + CO2 ↑+ H2O 。(3分)
若将少量稀盐酸,逐滴加入浓碳酸钠溶液中,无明显现象,反应的方程式
为 Na2CO3 + HCl === NaCl + NaHCO3 (2分)
19.(7分)银白色固体A,置于空气中可逐渐变为B,吸收水又逐渐变为C,最后变为D。将 A点燃,火焰呈黄色,生成淡黄色固体E。A、B、E均能与中性液体F反应生成C,且A还生成气体G,E还生成气体H。若点燃G与H的混合气体,可爆炸并化合生成F。据此推断
(1)A、B、E、G、H的化学式分别是:A Na ,B Na2O , E Na2O2 ,
G H2 ,H ___ O2__.
(2)写出E+F→C+H的化学方程式: 2Na2O2 + 2H2O === 4 NaOH + O2↑.(3分)
18. (6分) KClO3和浓盐酸在一定温度下反应会生成绿黄色的二氧化氯,其变化可表述为
2 KClO3 + 4 HCl(浓) ==2 KCl + 2 ClO2↑+ 1 Cl2↑+ 2 H2O
(1)请配平上述化学方程式(计量数填入横线上)(2分)
(2)浓盐酸在反应中显示出来的性质是 ② (填编号)(2分)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3)产生0.1mol Cl2,则转移的电子式的物质的量为 0.2 mol。(2分)
17.(14分)下图中A、B、C是常见的化学实验装置,请回答下列问题:
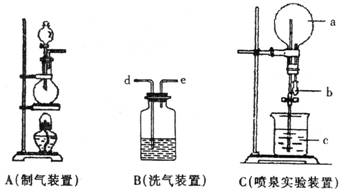
(1)利用A装置,当不加热时,可制取的气态单质是 H2 O2 Cl2 ;(至少回答两个)当加热时,可制取的气态化合物是 HCl NH3 。(至少1个答案)(4分)
(2)实验里用A装置加热制取氯气,有关化学方程式为:
MnO2 + 4 HCl(浓)==== MnCl2 + Cl2 ↑ + H2O .若没有浓盐酸,可
以用两种物质代替,它们是 浓H2SO4和NaCl ;为得到纯净干燥的氯气,可让A中出来的气体在进入收集装置前依次通过分别装有 饱和食盐水 和浓H2SO4 的两个洗气瓶。(6分)
(3)实验室收集氯气和二氧化碳都可用向上排空气法,具体操作有何不同?收集氯气需要
处理尾气,而收集CO2不需要(1分)
为什么?(2分) 因为氯气有毒,为了安全和不污染环境,必须将多余氯气吸收,而
CO2 不会。
(4)C装置中圆底烧瓶里充满了纯净、干燥的氯气,现用该装置做喷泉实验,如何操作才能形成喷泉?(3分)
挤压胶头滴管胶头将其中NaOH溶液挤入烧瓶,充分反应后打开旋塞,可以看到烧杯中水
喷入烧瓶
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com