
2、除去混在乙烷中的少量乙烯的方法是 ( )
A.将混合气体通过盛有溴水的洗气瓶 B.将混合气体与HCl加成 C.将混合气与H2加成 D.将混合气体通过盛有酸性KMnO4溶液的洗气瓶 3、研究发现,烯烃在合适催化剂作用下可双键断裂,两端基团重新组合为新的烯烃。若CH2=C(CH3)CH2CH3与CH2=CHCH2CH3的混合物发生该类反应,则新生成的烯烃中共平面的碳原子数可能为 ( )
A.2,3,4 B.3,4,5 C.4,5,6 D.5,6,7
1、(2007北京)将用于2008年北京奥运会的国家游泳中心(水立方)的建筑采用了膜材料ETFE,该材料为四氟乙烯与乙烯的共聚物,四氟乙烯也可与六氟丙烯共聚成聚全氟乙丙烯。下列说法错误的是 ( )
(A)ETFE分子中可能存在“-CH2-CH2-CF2-CF2-”的连接方式
(B)合成ETFE及合成聚全氟乙丙烯的反应均为加聚反应
(C)聚全氟乙丙烯分子的结构简式可能为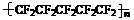
(D)四氟乙烯分子中既含有极性键又含有非极性键
29.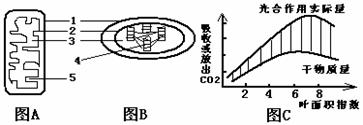 (18分)结合图A、B和C,回答下列有关问题:(注:叶面积指数是指单位土地面积上植物叶面积数量,此值越大,表示植物叶片交错程度越大。)
(18分)结合图A、B和C,回答下列有关问题:(注:叶面积指数是指单位土地面积上植物叶面积数量,此值越大,表示植物叶片交错程度越大。)
(1)组成图中[1]和[2] 的主要成分中都含有___________元素,其结构特点为_______,功能上都具有___________。
(2)A和B中能增加膜面积的结构分别为[ ]____________和[ ]_____________。
(3)A、B两种结构在遗传上都具有一定的自主性,这是因为____ ____
(4)根据图A、B在生理过程上的联系分析可知,C图中斜线部分表示____________。
(5)叶面积指数达到某值以后,光合作用的实际量不会随叶面积指数增加而增加,
原因是_________________________________________________________。
(6)研究一片成熟的森林生态系统,叶面积指数大约为_______时,进行合理开采最有利于森林生态系统的更新。
28.(14分)八角茴香属于草本植物,是我国民间常用作烹调的香料。医学研究成果显示,从八角茴香中可以提取到莽草酸,莽草酸有抗炎、镇痛作用,是合成某些抗癌药物的中间体,还是合成“达菲”的前体(“达菲”是对H1N1流感病毒有一定抑制作用的一种药物)。莽草酸的结构简式如图所示。
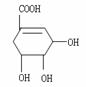 请回答下列问题:
请回答下列问题:
(1)观察图中分子结构写出在莽草酸分子中包含的官能团的名称 。
(2)莽草酸与氢氧化钠反应的化学方程式(有机物用结构简式表示)是
。
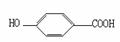 (3)莽草酸在浓硫酸作用下加热可得到B,已知B的结构简式为:
(3)莽草酸在浓硫酸作用下加热可得到B,已知B的结构简式为:
其反应类型是 。
(4)莽草酸跟有机物A在一定条件下发生酯化反应可生成一种相对分子质量为202的酯类物质,写出A可能的结构简式 、 。
(5)B的同分异构体中既含有酚羟基又含有醛基的共有 种,写出其中两种不同类别同分异构体的结构简式 , 。
27.(16分)Ⅰ、将20g硝酸钠和17g氯化钾投入到盛有35mL蒸馏水的100mL的烧杯中,通过加热、搅拌、浓缩、过滤来制备硝酸钾晶体。制备过程如下:
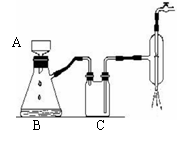

 根据上图回答下列问题
根据上图回答下列问题
(1) 步骤2加2mL蒸馏水的目的是 _________
(2) 实验过程中需用到如右图装置,该装置中A的名称是 ,C的作用是 。
(3) 步骤4的操作叫 。
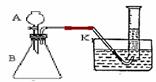 Ⅱ、课外活动小组的三名同学甲、乙、丙用右图装置探究不
同催化剂(CuO、MnO2、Fe2O3)对H2O2分解反应速率的影响。
Ⅱ、课外活动小组的三名同学甲、乙、丙用右图装置探究不
同催化剂(CuO、MnO2、Fe2O3)对H2O2分解反应速率的影响。
查阅资料:催化剂密度见下表
|
催化剂 |
Fe2O3 |
CuO |
MnO2 |
|
密度g/cm3 |
5.24 |
6.6 |
5.026 |
(1)教材中取三种催化剂(CuO、MnO2、Fe2O3)各0.1g,甲同学认为教材的方案欠科学性,并提出MnO2、Fe2O3各取0.10g,CuO应取0.12g。甲提出该改进方案的理由是
。
(2)乙将0.1gMnO2放入上图锥形瓶中,连接好装置后,向锥形瓶中加入6%的H2O210.0mL,30s时,量筒中气体体积为20.0mL。则反应生成氧气的速率为 L/s。
(3)丙同学发现乙同学用10.0mL量筒量取6%的H2O210.0mL,加到分液漏斗中,然后打开漏斗活塞将过氧化氢全部加入到锥形瓶中,丙同学指出乙同学的操作会给实验带来误差。请指出乙同学操作的欠妥之处 ,
应如何改进? 。
26.(12分)科学家认为,氢气是一种高效而无污染的理想能源。近几十年来,对以氢气作为未来的动力燃料氢能源的研究获得了迅速发展。
(1)为了有效发展民用氢能源,首先必须制得廉价的氢气。下列可供开发又较经济且资源可持续利用的制氢气的方法是 。(选填字母)
A.以石油、天然气为原料 B.金属和稀硫酸反应 C.光解海水 D.电解水
(2)氢气易燃易爆,贮运安全已成为影响它广泛进入民用的一大因素。已知氢气的热值为143kJ·g-1。则氢气燃烧生成液态水的热化学方程式为: 。
(3)氢气除直接用作燃料外,可用于生产各种电池。氢镍电池是一种应用广泛的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电池的总反应为
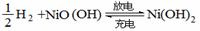 。则该电池作为电源使用时,负极上放电的物质是
。
。则该电池作为电源使用时,负极上放电的物质是
。
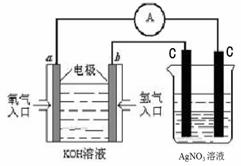
(4)氢氧燃料电池能量转化率高,具有广阔的发展
前景。现用氢氧燃料电池进行右图所示实验:
①氢氧燃料电池中,正极的电极反应式为
。
②在右图装置中盛有100mL、0.1mol·L-1AgNO3
溶液,当某一石墨电极的质量增加1.08g时,则
此时该装置中溶液的pH = 。 第27题图
(5)水煤气法制H2是目前工业上常用的方法之一。已知CO(g) +H2O(g)  CO2(g)
CO2(g)
+H2(g)在800℃时平衡常数K=1。若反应在800℃进行,起始时CO和H2O(g)共为5mol,水蒸气的体积分数为x;平衡时CO转化率为y,则y随x变化的函数关系式为:y = 。
25.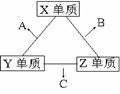 (16分) X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如右图变化,一个B分子中含有的Z原子个数比C分子中少1个。请回答下列问题:
(16分) X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如右图变化,一个B分子中含有的Z原子个数比C分子中少1个。请回答下列问题:
⑴ X元素的原子结构示意图 ;Y元素在周期表中的位 置是第 周期 族。
⑵ ①C分子的结构呈 形。
② C在一定条件下反应生成A的化学方程式是 。
③X、Y、Z三种元素可组成一种强酸W,C在适当条件下被W吸收生成一种盐。写出该盐阳离子的电子式 ;该盐的水溶液pH 7(填“大于”、“小于”、“等于”),其原因是(写离子方程式): 。
⑶ 已知Y单质与Z单质生成C的反应是可逆反应,△H<0。将等物质的量的Y、Z两种单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法正确的有 。
A.达到化学平衡时,正反应速率和逆反应速率相等
B.达到化学平衡时,Y、Z两种单质在混合气体中的物质的量之比为1:1
C.达到化学平衡的过程中气体平均相对分子质量减小
D.达到化学平衡后,升高温度,C的体积分数减小
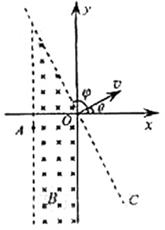
24、如图所示,在坐标系xOy中,过原点的直线OC与x轴正向的夹角φ=120°,在OC右侧有一匀强电场;在第二、三象限内有一匀强磁场,其上边界与电场边界重叠、右边界为y轴、左边界为图中平行于y轴的虚线,磁场的磁感应强度大小为B,方向垂直纸面向里。一带正电荷q、质量为m的粒子以某一速度自磁场左边界上的A点射入磁场区域,并从O点射出,粒子射出磁场的速度方向与x轴的夹角θ=30°,大小为v。粒子在磁场中的运动轨迹为纸面内的一段圆弧,且弧的半径为磁场左右边界间距的两倍。粒子进入电场后,在电场力的作用下又由O点返回磁场区域,经过一段时间后再次离开磁场。已知粒子从A点射入到第二次离开磁场所用的时间恰好等于粒子在磁场中做圆周运动的周期。忽略重力的影响。求
(1)粒子经过A点时速度的方向和A点到x轴的距离;
(2)匀强电场的大小和方向;
(3)粒子从第二次离开磁场到再次进入电场时所用的时间。
23.如图所示,绝缘光滑水平轨道AB的B端与处于竖直平面内的四分之一圆弧形粗糙绝缘轨道BC平滑连接,圆弧的半径R=0.40m。在轨道所在空间存在水平向右的匀强电场,电场强度E=1.0×104N/C。现有一质量m=0.10kg的带电体(可视为质点)放在水平轨道上与B端距离s=1.0m的位置,由于受到电场力的作用带电体由静止开始运动,当运动到圆弧形轨道的C端时,速度恰好为零。已知带电体所带电荷量q=8.0×10-5C,取g=10m/s2,求:
(1)带电体在水平轨道上运动的加速度大小及运动到B端时的速度大小;
(2)带电体运动到圆弧形轨道的B端时对圆弧轨道的压力大小;
(3)带电体沿圆弧形轨道从B端运动到C端的过程中,摩擦力做的功。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com