
【题目】为测定某纯碱样品(含少量氯化钠杂质)中碳酸钠的含量,取12g样品放入烧杯中,加入100g稀盐酸,恰好完全反应。经测定,所得溶液常温下为不饱和溶液,其质量为107.6g(产生的气体全部逸出)。试计算:
(1)反应生成的二氧化碳的质量为多少?
(2)12g样品中碳酸钠的质量为多少?
(3)反应后所得溶液中溶质的质量分数是多少?
科目:初中化学 来源: 题型:
【题目】根据图实验装置,请回答:

(1)仪器 a 的名称是______。
(2)用H2O2制取氧气,选择的发生装置为______(填字母),反应的化学方程式为___。
(3)用装置 F 和另一仪器(除导管外)收集并测量O2体积,另一仪器名称为____ , 在 F 中气体应从导管____(填“b”或“c”)端通入。
(4)实验室里,常用加热无水醋酸钠和碱石灰固体混合物的方法,制备甲烷。选择的发生装置为____(填字母)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在目前全民抗击“新冠肺炎”的疫情中,人们采取的防护措施有很多,其中之一是通过涂抹浓度为75%的医用酒精溶液进行消毒,下列有关说法正确的是
A.酒精是由9个原子构成的
B.酒精中C、H、O 三种元素的质量比为2:6:1
C.酒精属于有机混合物
D.酒精的相对分子质量为46
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阅读下面的科普材料。
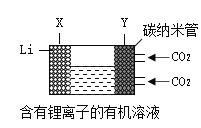
2019年度诺贝尔化学奖被授予约翰·古迪纳夫、斯坦利·惠廷厄姆和吉野彰三位科学家,以表彰其在锂离子电池的发展方面作出的贡献,奠定了无线电子产品的基础,给予我们进入无化石燃料世界的可能性,因为它能用于各种事物,从给电动汽车供电到从可再生能源中储存能量。
新能源汽车按照电池种类的不同可以分为镍氢电池动力汽车、锂电池动力汽车和燃料电池动力汽车。镍氢电池具有大功率、快速充放电等优点,但也有成本高,自放电程度大等不足,锂电池在整个充放电过程中,锂离子往返于正负极之间实现能量的转化。锂电池月自放电率仅为6%~8%,远低于镍氢电池。由于正极材料LiCoO2的价格高,目前是市场上高端电动汽车的主要动力源。质子交换膜燃料电池是燃料电池中的一种,其工作原理是在催化剂的作用下,氢气、氧气分别在各自电极发生电离后生成水,并释放出能量。由于质子交换膜燃料电池以铂族贵金属作电催化剂,燃料净化程度要求高,并且只能用热水回收余热,所以并未广泛应用。
(1)化石燃料是_____能源(填“可再生”或“非可再生”)。
(2)质子交换膜燃料电池可实现零排放,该反应的化学方程式是_____,能量转化形式为_____
(3)现有一种锂离子二次电池,其工作原理如图。放电时生成的Li2CO3固体和碳储存于碳纳米管中。放电时,电池的总反应为_____。
(4)下列说法中正确的是_____
A镍氢电池汽车具有大功率、快速充放电等优点
B锂电池月自放电率高,远高于镍氢电池
C电池属于无害垃圾,可以随意丟弃
D质子交换膜燃料电池电源是一种清洁的绿色环保电源
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】抗击“新型冠状病毒”用到的过氧乙酸(C2H4O3)是一种高效消毒剂。可由冰醋酸(C2H4O2)和双氧水在浓硫酸催化作用下制得,实验装置和步骤如下:
步骤1:在三颈烧瓶中加入一定量冰醋酸与浓硫酸的混合物,再缓缓加入适量30%的双氧水;步骤2:不断搅拌并控制三颈烧瓶中混合液的温度为20~30℃至反应结束,在锥形瓶中收集产品。
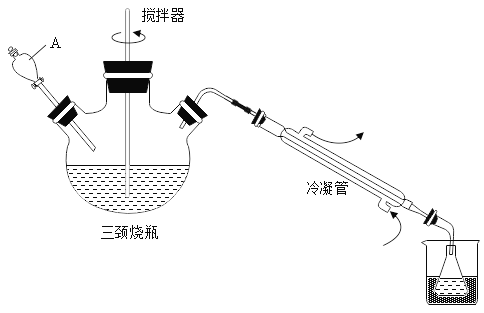
(1)仪器A的名称是_____
(2)步骤2搅拌的目的是_____
(3)下列关于过氧乙酸和冰酷酸的说法正确的是_____
a、过氧乙酸属于氧化物
b、过氧乙酸的相对分子质量为76
c、冰醋酸中C、H、O元素的质量比为6:1:8
d、过氧乙酸中氧元素的质量分数小于冰醋酸中氧元素的质量分数
(4)实验测得生成物过氧乙酸的质量分数随反应物比例![]() 和反应时间的变化数据如下表。由表中数据可知,反应物最佳比例是_____;最佳反应时间约_____。
和反应时间的变化数据如下表。由表中数据可知,反应物最佳比例是_____;最佳反应时间约_____。
反应物比例 | 反应时间 | |||||
0.5h | 1h | 3h | 5h | 7h | ||
2:1 | 7.38% | 8.46% | 9.42% | 11.26% | 13.48% | |
1:1 | 10.56% | 12.92% | 13.54% | 20.72% | 20.80% | |
1:2 | 6.14% | 7.10% | 7.96% | 10.38% | 12.36% | |
(5)产品中过氧乙酸的质量分数的测定方法如下:取5.00g过氧乙酸产品,加水稀释成100g溶液;从取出5.00g溶液,先除去残余的H2O2,再加入稍过量的KI溶液,充分发生反应:C2H4O3+2KI+H2SO4=K2SO4+I2+C2H4O2+H2O,反应结束后,经实验测得生成I2的质量为0.127g,试计算原产品中过氧乙酸的质量分数。_____(写出计算过程,结果保留1位小数)。
(6)请根据你学过的“一定溶质质量分数溶液的配制”方法配制0.5%的过氧乙酸,用于地面、墙壁、门窗的消毒。
(实验用品)溶质质量分数为20%的过氧乙酸(密度为1.0261g/cm3)、水、1000mL量筒、10L塑料桶、木棒、口罩、眼镜、橡皮手套。
(实验步骤)①计算:将200mL20%的过氧乙酸(密度为1.026g/cm3)稀释为0.5%的过氧乙酸,需加入水的体积为_____mL(计算结果保留一位小数);
②配制:用量筒量取200mL20%的过氧乙酸倒入塑料桶中,按比例兑水,用木棒搅拌后,盖好桶盖待用。
(实验反思)
①由于过氧乙酸有腐蚀性,因此在配制溶液时要注意_____;
②在配制过氧乙酸过程中不能用铁器皿,原因是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将一定量的AgNO3和Al(NO3)3混合溶液进行如图实验,已知溶液A呈蓝色。

(1)溶液A中的溶质一定有Fe(NO3)2、____和____(填化学式,下同)。
(2)固体B中一定不含有的金属是__;一定含有的金属是___。
(3)混合溶液中加入铜粉和铁粉最先发生的反应方程式__。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】湿地之都,水绿盐城!
(1)新四军纪念馆是盐城市的名片之一。馆内有许多抗战时的枪炮,但有些表面出现锈迹,其主要原因是:铁与_______等物质共同作用的结果。稀盐酸可用来除铁锈,化学方程式为_______。
(2)郭猛的温泉度假村是人们休闲的好去处。
①温泉水富含钾、钙、镁、氟、硅等,这里的“钾、钙、镁、氟、硅”指的是_______(填序号)。
A 分子 B 原子 C 元素 D 单质
②温泉水的pH在7.5~8.9之间,若先将pH试纸用蒸馏水润湿,再进行测定,则所测得的结果_______(填“偏大”、“偏小”或“不受影响”)。
(3)自来水的生产过程如图所示。
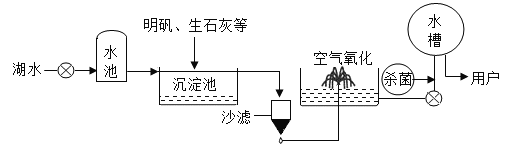
①上述生产过程中使用的净水方法有_______(填序号)。
A 沉淀 B 过滤 C 煮沸 D 蒸馏
②自来水用氯气杀菌消毒。请将下列化学方程式补充完整:Cl2+ H2O = HClO +_______。
③能否用硝酸银区分该厂的自来水和蒸馏水________(填“能”或“不能”)。
(4)清洗餐具上的油污,常在水中加少量洗洁精,洗洁精所起的作用是_______。
(5)配制10%的氯化钠溶液时,会引起溶液中氯化钠质量分数偏大的是_______(填序号)。
A 用量筒量取水时俯视读数 B 配制溶液的烧杯中残留少量蒸馏水
C 氯化钠晶体不纯 D 转移已配好的溶液时,有少量溶液溅出
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图A-F都是初中化学常见的物质.图中的反应条件已略去.已知A常温下为液体,F是一种难溶性的蓝色固体.(资料:难溶性碱受热易分解为两种氧化物,反应中各元素化合价不变).请回答下列问题.
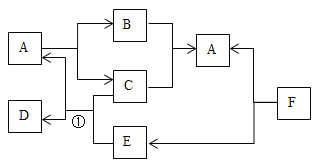
(1)F的化学式为_____.
(2)反应①的基本类型为_____________________;
(3)写出另一个F能发生的反应方程式_____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】草酸锌晶体(ZnC2O42H2O)是一种白色固体,微溶于水,熔点为100℃.以锌为原料制备草酸锌晶体的一种生产工艺如图:
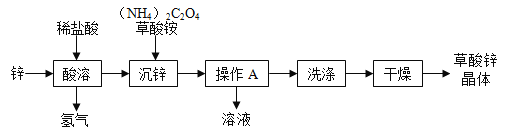
(1)根据草酸铵的化学式,可推测草酸的化学式是_______。
(2)“酸溶”过程中发生反应的化学方程式是____,该反应属于基本反应类型中的____反应。
(3)“沉锌”过程中发生反应的化学方程式是_____。
(4)“操作A”的名称是____,分离出的溶液可用作____(写一种用途)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com