
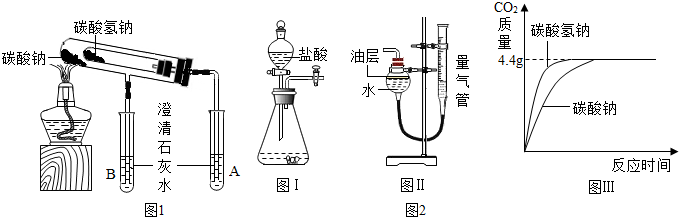
分析 【实验探究】比较两种物质的溶解性:根据20℃时,Na2CO3、NaHCO3的溶解度分别为21.5g和9.6g,判断20℃时,取2只烧杯,均加入50g水,分别加入5gNa2CO3和NaHCO3,充分搅拌后静置,则观察到的现象;
比较两种物质的酸碱性:根据Na2CO3和NaHCO3溶液均为碱性溶液,判断滴加紫色石蕊试液后溶液的颜色;
比较两种物质的热稳定性:根据碳酸氢钠在270℃时会分解生成Na2CO3、H20和CO2,而Na2CO3受热不易分解分析作答;
比较与盐酸反应生成相同体积二氧化碳气体的快慢:根据图表信息,完成计算并分析作答.
解答 解:【实验探究】比较两种物质的溶解性:根据20℃时,Na2CO3、NaHCO3的溶解度分别为21.5g和9.6g,可以判断20℃时,取2只烧杯,均加入50g水,分别加入5gNa2CO3和NaHCO3,充分搅拌后静置,则观察到的现象:碳酸钠完全溶解,碳酸氢钠部分溶解;
比较两种物质的酸碱性:根据Na2CO3和NaHCO3溶液均为碱性溶液,判断滴加紫色石蕊试液后溶液的颜色均显蓝色,要比较二者的碱性强弱,可以分别测溶液的pH;
比较两种物质的热稳定性:根据碳酸氢钠在270℃时会分解生成Na2CO3、H20和CO2,而Na2CO3受热不易分解分析:设计如图1装置:小试管套装在带有支管的大试管中,整套装置气密性好,其他装置略去.
(1)为确保安全,防止冷水倒流炸裂试管,实验结束时,在熄灭酒精灯前必须完成的操作是:把A、B试管中的导管移出液面;
(2)现象与结论:根据碳酸氢钠在270℃时会分解生成Na2CO3、H20和CO2,而Na2CO3受热不易分解,又装有碳酸氢钠的试管口生成较多的无色小液滴;判断试管A和试管B中澄清石灰水只有 A中变浑浊,碳酸氢钠分解的化学反应方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2 O+CO2↑.
(3)反思与讨论:加热大试管时,碳酸钠的受热温度会高于碳酸氢钠.这能准确地说明“在受热条件下,碳酸钠比碳酸氢钠稳定”这一结论;因为碳酸钠受热的温度更高却没分解,说明受热条件下碳酸钠比碳酸氢钠稳定;
比较与盐酸反应生成相同体积二氧化碳气体的快慢:根据图表信息,
(1)已知二氧化碳不溶于该油层,图2Ⅱ装置中油层的作用是:防止部分的二氧化碳溶于水,造成实验误差
(2)设:消耗碳酸钠的质量为b,消耗碳酸氢钠的质 量为a
Na2CO3+2HCl═2NaCl+H2 O+CO2↑ NaHCO3+HCl═NaCl+H2 O+CO2↑
106 44 84 44
b 4.4g a 4.4g
$\frac{106}{b}$=$\frac{44}{4.4g}$ $\frac{84}{a}$=$\frac{44}{4.4g}$
b=10.6g a=8.4g
(3)结论:根据以上信息,在相同的条件下,生成相同体积的二氧化碳,碳酸氢钠与盐酸反应比碳酸钠与盐酸反应快;
(4)反思与讨论:实验中“取碳酸氢钠a克、碳酸钠b克”的目的是生成相同体积的二氧化碳.
故本题答案为:
【实验探究】
比较两种物质的溶解性:碳酸钠完全溶解,碳酸氢钠部分溶解;
比较两种物质的酸碱性:蓝;pH;
比较两种物质的热稳定性:
(1)把A、B试管中的导管移出液面;
(2)现象与结论:A; 2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2 O+CO2↑.
(3)反思与讨论:能;碳酸钠受热的温度更高却没分解,说明受热条件下碳酸钠比碳酸氢钠稳定;
比较与盐酸反应生成相同体积二氧化碳气体的快慢:
(1)防止部分的二氧化碳溶于水,造成实验误差;
(2)a=8.4g;b=10.6g;
(3)结论:碳酸氢钠与盐酸反应比碳酸钠与盐酸反应快;
(4)反思与讨论:生成相同体积的二氧化碳.
点评 本题考查了Na2CO3和NaHCO3的性质,完成此题,可以依据已有的知识进行.


 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案科目:初中化学 来源: 题型:选择题
| A. | 该领域其他专家的意见 | |
| B. | 实验报告撰写的详细程度 | |
| C. | 该科学家是否为这一领域的权威 | |
| D. | 他人能否重复其实验并得到相同的结果 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 食物 | 葡萄 | 牛奶 | 苹果 | 豆制品 |
| pH | 3.5一4.5 | 6.3-6.6 | 2.9-3.3 | 7.4一7.9 |
| A. | 豆制品 | B. | 苹果 | C. | 牛奶 | D. | 葡萄 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Fe,Hg | B. | Fe,Zn | C. | Cu,Hg | D. | Cu,Zn |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Mg | B. | K2O | C. | CO2 | D. | NaOH |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质(括号内为杂质) | 试 剂 | 操 作 |
| A | FeCl2溶液(CuCl2) | 适量锌粉 | 过滤 |
| B | 铜粉(Fe) | 足量稀硫酸 | 过滤,洗涤,烘干 |
| C | MnO2(NaCl) | 适量水 | 溶解、过滤,蒸发、结晶 |
| D | NaCl(KNO3) | 适量热水 | 充分溶解后,降温结晶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com