
����Ŀ��ij�Ͻ���Ҫ�ɷ�ΪZn��Fe��Cu�����������������ֽ�������������øúϽ��ƳɵĻ�е�����������ȡ�ߴ���ZnO���䲿�ֹ�����������ͼ��ʾ����֪:Zn�� OH��2����NaOH��ǿ���γɿ������Ρ��ش��������:
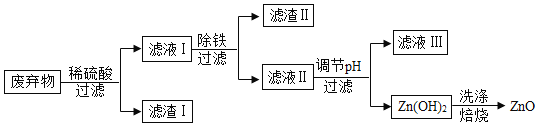
��1������I��һ����___________________��
��2�������ܽ������ʱ����Ҫͨ�粢Զ���Դ����ԭ����_____�� �˹�����Zn������ȥ��ͭ�����������.д���÷�Ӧ�Ļ�ѧ����ʽ:_________________��
��3��ͼʾ������"�����У��Ƚ�Fe2+ת��ΪFe3+���ټ���NaOH��Һ��ȥ���������д����ȥ����������Ļ�ѧ����ʽ:_________________ ���÷�Ӧ����____________________ ���������Ӧ���ͣ���
��4��ͼʾ��������pH"����NaOH�������ܹ�������ԭ����________________����һ�����У��� pH��ֽ����Һ�����ȣ����������Ϊ___________________��
���𰸡�Cu����ͭ�� ���ⷴӦ��������������������ը ![]()
![]() ���ֽⷴӦ ������NaOH��ʹZn(OH)2�ܽ� �ڱ������Ϸ�һС��pH��ֽ���ò�����պȡ����Һ����pH��ֽ�ϣ�����ɫ�ȶ��������ɫ���ȶԣ�����pH
���ֽⷴӦ ������NaOH��ʹZn(OH)2�ܽ� �ڱ������Ϸ�һС��pH��ֽ���ò�����պȡ����Һ����pH��ֽ�ϣ�����ɫ�ȶ��������ɫ���ȶԣ�����pH
��������
��1��Cu��ϡ�����Ӧ������I��һ����Cu����ͭ����
��2�������ܽ������ʱ������ȼ�������������ɣ���Ҫͨ�粢Զ���Դ����ԭ���DZ��ⷴӦ��������������������ը���˹�����Zn������ȥ��ͭ����������ã�ͭ������Ϊ����ͭ��ϡ���ᷴӦ���ɵ�����ͭ������ͭ��п��Ӧ��������п��ͭ���÷�Ӧ�Ļ�ѧ����ʽ: ![]() ��
��
��3��ͼʾ������"�����У��Ƚ�Fe2+ת��ΪFe3+���ټ���NaOH��Һ��ȥ������������������������Ʒ�Ӧ���������ƺ�����������������Ӧ�Ļ�ѧ����ʽ: ![]() ���÷�Ӧ���ڸ��ֽⷴӦ��
���÷�Ӧ���ڸ��ֽⷴӦ��
��4��Zn(OH)2����NaOH��ǿ���γɿ������Σ�ͼʾ�С�����pH"����NaOH�������ܹ�������ԭ���ǹ�����NaOH��ʹZn(OH)2�ܽ⣬����һ�����У��� pH��ֽ����Һ�����ȣ����������Ϊ���ڱ������Ϸ�һС��pH��ֽ���ò�����պȡ����Һ����pH��ֽ�ϣ�����ɫ�ȶ��������ɫ���ȶԣ�����pH��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧС����ͼ1װ����֤������̼��ˮ�ķ�Ӧ��

����Ũ�� | �۲쵽������ | |
���� | Ũ���ᣨ36.5%�� | B��ʯ����Һ����ɫ��ɺ�ɫ C��ʯ����Һû�б�Ϊ��ɫ |
���� | ϡ���ᣨ13.5%�� | B��ʯ����Һ����ɫ��Ϊ��ɫ C��ʯ����Һ��Ϊ��ɫ |
��1��A�з�Ӧ�Ļ�ѧ����ʽΪ_____��
��2������C�з�Ӧ�Ļ�ѧ����ʽΪ_____��
�������뽻����ͬѧ����Ϊ����C��ʯ����Һû�б�Ϊ��ɫ������ΪŨ����ӷ��������HCl����ʯ����Һ��
��������룩����Ļӷ�����Ũ���йء�
������ʵ�飩��ͼ2װ���о���ͬŨ������Ļӷ��ԡ������Ӵ������ⶨ�ձ���������Һ��������Ũ�ȣ�������Ũ�ȿ��Խ��Ʊ�ʾ�ӷ�����HCl��������ʵ�����ݼ��±���
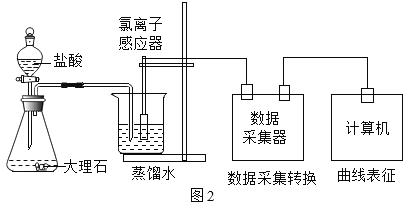
����Ũ����������Ũ�ȵĶ�Ӧ��ϵ����ͬʱ���ڲ�ã�
����Ũ�ȣ�%�� | 13.5 | 20 | 26.2 | 29.2 | 32.2 | 36.5 |
������Ũ�ȣ�mg/L�� | 1.1 | 1.4 | 3.7 | 19.0 | 59.8 | 209.2 |
���������������ܹ��ó�����Ļӷ�����Ũ�ȵĹ�ϵ��_____��
���ó����ۣ�������ȷ
��ʵ�鷴˼������ʯ����Һ��첻��֤��������̼��ˮ��Ӧ��
��ʵ��Ľ�������ͬѧ��װ��A��װ��B֮������װ��D������װ��֮�䵼�ܿڵ�����˳���ǣ�a��_____ ��_____��b��ѡ��NaHCO3��Һ���ӵ�ԭ����_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ��װ��ͼ�ش��������⣺
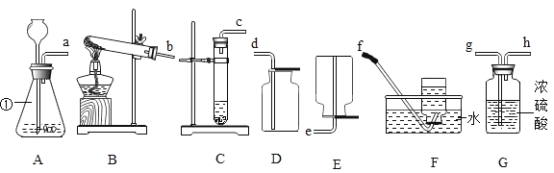
��1��д��ͼ�Тٵ��������ƣ�______��
��2��С��ͬѧ�ø����������������ѡ���� B װ�ã�B װ�ô���һ��������________����װ�����Թܿ�Ҫ��������б��ԭ���� _________������ D װ���ռ������������ķ����ǣ�______________��������˵����
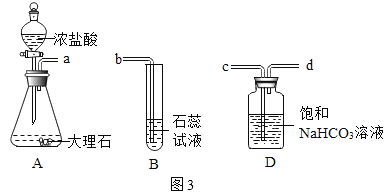
��3��С��ͬѧ�ù���������Һ���������Ϊԭ����ȡһƿ�������������ѡװ����ȷ���� ��˳���ǣ���ܿ��Աߵ�Сд��ĸ��________����ʾ��G װ���е�Ũ���������ˮ�������������壩��
��4��װ�� A �� C ��������Ϊʵ������ȡ�����ķ���װ�ã�A �� C �Ƚϣ�A װ�þ��е��ŵ���_____ ������������ţ�
������������ȡ�϶����� �ڿ����濪���ã������ͣ �ۿ���ʱ����Һ��ҩƷ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Ǽס��ҡ������ֹ������ʵ��ܽ�����ߣ������ͼʾ��գ�
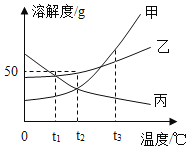
��1��t1��Cʱ���ס��ҡ����������ʵ��ܽ�ȴ�С��ϵ��_____��
��2��t2��Cʱ�������ʵı�����Һ�����ʡ��ܼ�������֮��Ϊ_____������������ȣ���
��3����������ͬ�����������ҡ���������Һ��Ӧ�����¶���_____��C��
��4����t2��Cʱ�ס��ҡ����������ʵı�����Һ���ֱ�����t1��C��������Һ���������������Ĵ�С��ϵ��_____��
��5��t2��C����40g������Ͷ��50gˮ�г���ܽ⣬������Һ������Ϊ_____g����ʹʣ����������ȫ�ܽ����ٻ����ˮ������Ϊ_____g��
��6�������к����������Һͱ�ʱ���ɲ���_____�������������������������ᾧ�ķ����ᴿ�����ʡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ�Ȼ��ơ�̼���ƣ��׳ƴ����ˮ�е��ܽ�����ߡ�����˵����ȷ����
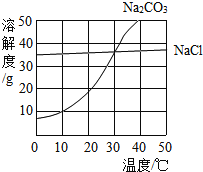
A.10 ��ʱ������̼������Һ��������������Ϊ10%
B.20 ��ʱ���Ȼ��ơ�̼�����ܽ����ͬ
C.�����ʺ�ɹ�Σ���Ϊ�Ȼ��Ƶ��ܽ�����¶����߶�����
D.�����ʺ��̼��Ϊ������ܽ�����¶Ƚ��Ͷ����Լ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ѧ���߱���ѧʵ�鼼���ǽ��п�ѧ̽����Ļ����ͱ�֤������ͼʾʵ���������ȷ����
A.  �������� B.
�������� B. 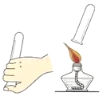 ����H2�Ĵ���
����H2�Ĵ���
C. 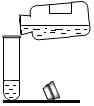 �㵹Һ�� D.
�㵹Һ�� D.  ����Һ��pH
����Һ��pH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ڹ���������������Ҫ�����ã�ͼ1Ϊ�ߩ�15�ɻ�������������ɣ�
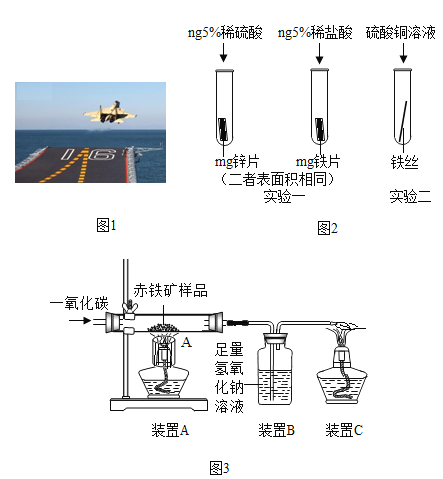
��1�����Ͻ���������ɻ�����ǣ����Ͻ���ʵ���Ҫ�ŵ���______��д��һ�㼴�ɣ���
��2����װǰ�������������⼣�߰ߣ���������ʴ��Ҫ����������е�_______��ͬ���õĽ������ҵ�����г���ϡ�����ȥ����Ʒ��������⣬�÷�Ӧ�Ļ�ѧ����ʽΪ______.
��3��Ϊ�˱����ִ��ĸ�����DZ���ʴ��ͨ�����ִ��������Ƕ�������ǿ������С��Ϊ̽��п������ͭ���ֽ����Ļ��˳���������ͼ2������ʵ�飺
��ʵ��һ�У�С��������������������ݵĿ�����Ϊ�����ж�п�����Ļ��ǿ������ͬѧ��Ϊ����������������_______��
��ʵ����У�������__����֤�����Ļ��ǿ��ͭ���÷�Ӧ�Ļ�ѧ����ʽΪ__��
��4���������Ľ���ķ��˴����ĸֲģ�ij��ȤС����ʵ������ͼ3��ʾװ��ģ�������Ļ�ѧԭ�������ⶨ��������������������������װ�����������ã���Ӧ��ȫ�ҳ������е����ʲ��μӷ�Ӧ�����س�������Ʒ������Ϊwg����
��װ��B�з�����Ӧ�Ļ�ѧ����ʽΪ____��
��Ҫ�ⶨ�ó�������Ʒ����������������������Ҫ������������__��__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮɹ�κ�õ��ľ����Ǵ��Σ�ʣ���Һ���Ϊ��±����±�г��Ȼ��������MgCl2��KCl��MgSO4���ʣ���ͼ�����ǵ��ܽ�����ߣ���ش�
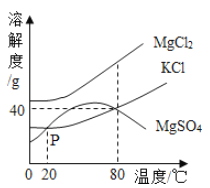
��1��P������_____��
��2��80��ʱ����40gKC1����50gˮ�У�������Һ������Ϊ_____g��
��3����80���MgCl2��KCl��MgSO4�������ʵı�����Һ���¶Ƚ���20�棬��ʱ������Һ�����ʵ����������Ĺ�ϵ��_____�����á��������������������ֻ�ѧʽ��ʾ����
��4�������¶�80�棬��100g���ʵ���������Ϊ10%��MgSO4��Һ��ɱ�����Һ�����������MgSO4���������Ϊ_____��
��5����֪�Ȼ��Ƶ��ܽ�����¶�Ӱ��仯���������Ȼ��Ƶı�����Һ�������Ȼ��ƾ��壬���õķ��������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʵ������ȡ��ѧ���ر��Ļ���ʵ�鼼�ܣ����������װ�ûش�����:
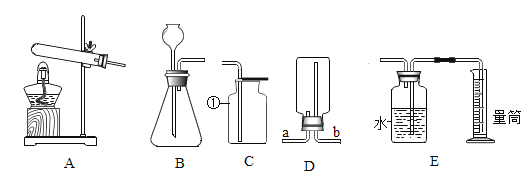
(1)д��Cװ���������ٵ�����_______
(2)ʵ���Ҽ��ȸ��������ȡ�����Ļ�ѧ����ʽΪ_______
(3)����Dװ���ռ�������Ӧ�ӹܿ�______(����a������b��)���룻
(4)��ͼ�е�Eװ��������������������������в���ʱ������ƿδװ��ˮ���Ƿ��Ӱ��ʵ����____(����������������)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com