
【题目】如图为甲、乙、丙三种固体物质的溶解度曲线图,请回答下列问题.
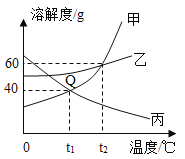
(1)Q点的含义是___________;
(2)若使接近饱和的丙溶液转变成饱和溶液,可采取的方法是___________(任写一种方法);
(3)甲中含少量乙时,可通过___________的方法提纯甲;
(4)t2℃时,将35g甲加入到50g水中,充分搅拌后,所形成溶液的质量为___________;
(5)将t2℃的甲、乙、丙三种物质的饱和溶液降温至t1℃,所得三种溶液溶质质量分数关系正确的是___________(填选项字母).
A 甲=丙<乙 B 甲=乙>丙 C 乙>甲>丙
【答案】t1℃时,甲和丙的溶解度相等 增加溶质(或升高温度、蒸发溶剂) 降温结晶 80g C
【解析】
(1)由溶解度曲线可知:Q点表示t1℃时,甲和丙的溶解度相等;故答案为:表示t1℃时,甲和丙的溶解度相等;
(2)若使接近饱和的丙溶液转变成饱和溶液,可采取的方法是:升高温度、增加溶质、蒸发溶剂;故答案为:增加溶质(或升高温度、蒸发溶剂);
(3)甲中含少量乙时,可通过降温结晶的方法提纯甲,因为甲的溶解度随温度变化比乙大;故答案为:降温结晶;
(4)t2℃时,甲的溶解度是60g,将35g甲加入到50g水中,充分搅拌后,所形成溶液的质量=30g+50g=80g;故答案为:80g;
(5)将t2℃的甲、乙、丙三种物质的饱和溶液降温至t1℃,所得三种溶液溶质质量分数关系正确的是乙>甲>丙,因为甲析出的固体比乙多,丙由饱和变为不饱和,故答案为:C。


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:初中化学 来源: 题型:
【题目】定量实验是一种重要的化学研究方法,同学们为探究一瓶久置的氢氧化钠固体的成分进行了甲、乙两组定量实验,其中实验过程,所用的药品及用量、生成的气体和沉淀质量如下:
甲组:取2g固体,滴如过量稀盐酸

乙组:取2g固体先溶解,滴加过量氯化钙溶液
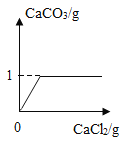
(l)通过实验,可以确定该瓶固体的成分为_______;
(2)结合给出数据,计算若利用氢氧化钙提纯20g该固体,需要![]() _____g:
_____g:
(3)反应后,为了实现无害化处理,同学们将甲、乙两组所得的废液混合,得到白色浑浊的液体,过滤后,可以选择下列药品中的_______确定滤液的成分。
A 酚酞 B ![]() C
C ![]() D 碳酸钠溶液
D 碳酸钠溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
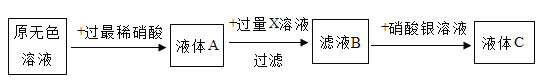
【题目】有一瓶Na2SO4溶液,可能混有NaCl,NaHCO3,NaOH,Na2CO3中一种或者几种,为了鉴别其溶质成分,查阅资料得知:Na2SO4溶液和NaCl溶液显中性,NaHCO3和Ba(NO3)2在溶液中不能反应;Ba(NO3)2在溶液中不能与CO2反应;NaHCO3和NaOH在溶液中能够反应,反应方程式为NaHCO3+NaOH=Na2CO3+H2O;实验过程如下:
Ⅰ.取少量溶液于试管中,加入一定量的稀硝酸,没有气泡产生,滴加几滴无色酚酞溶液,溶液呈红色,原溶液中除Na2SO4外一定还有溶质是_____________。
Ⅱ.另取少量溶液于试管中,加入过量的Ba(NO3)2溶液,过滤;得到滤液和滤渣,在滤渣中加足量稀硝酸,固体质量与加入稀硝酸关系如下图;可以观察到的现象是_____________;在滤液通入CO2,滤液变浑浊,滴加几滴酚酞溶液,浑浊液体不变红,滤液产生浑浊的化学方程式为_________。

III.为了确定原溶液中溶质成分,兴趣小组同学进行实验如下,x是______________;液体C含有的溶质有_______;结论是原溶液中含三种溶质.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硫酸是化工生产中重要的酸,其产量最大,用途最广,消耗量最多。历史上曾将硫酸的产量或消耗量作为一个国家化工生产发达程度的标志。
浓硫酸具有吸水性、脱水性和强氧化性。浓硫酸的腐蚀性主要是由它的脱水性和强氧化性引起的。稀硫酸有强酸性,稀硫酸的腐蚀性则主要是由酸性及水分蒸发后变浓而产生的。
硫酸的用途极广,常用于生产化肥、冶炼金属、农药、制药等。
工业制硫酸的流程为:FeS2![]() SO2
SO2 SO2
SO2 H2SO4
H2SO4
(1)综合分析以上材料,并结合已有知识,请回答:
①工业制H2SO4可能会引起的环境问题是_____。
②在实验室中不慎将浓硫酸沾到皮肤上的处理方法是_____。
A 立即用大量水冲洗,然后再涂上3%~5%的碳酸氢钠溶液。
B 立即用稀氢氧化钠溶液冲洗,然后再用水冲洗。
(2)某工厂化验室用9.8%的稀硫酸洗涤一定量化工产品中残留Ba(OH)2,当消耗稀硫酸100g时,沉淀不再产生,此时液体的pH=7(不考虑其它物质的影响),求化工产品中残留Ba(OH)2的质量。_____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水是宝贵的自然资源,在生产和生活中都有极其广泛的应用,请回答下列问题:
(1)经过水质检验的自来水在运输过程中存在细菌污染,饮用该水前的处理方法是_____。
(2)硬水与软水的区别是_____。
(3)长期烧水的壶会有水垢,其成分为CaCO3和Mg(OH)2,实验室从该水垢中提取氯化钙晶体的主要流程如图:
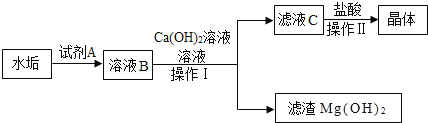
(ⅰ)试剂A是一种酸,其化学式为_____。
(ⅱ)溶液B中加入Ca(OH)2溶液除去的主要离子是_____,写出发生的化学反应方程式_____,操作Ⅰ的名称是_____。
(ⅲ)向滤液C中加入盐酸的主要目的是_____,操作Ⅱ的名称是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】螃蟹味道鲜美,营养丰富,蟹肉中含有的烟酸(化学式:C6H5NO2)是人体必需的13中维生素之一,具有扩张血管的作用.
(1)烟酸中碳、氢原子个数比为___________;
(2)烟酸中氮、氧元素的质量比为___________;
(3)烟酸中碳元素的质量分数为___________(计算结构精确到0.1%);
(4)246g烟酸中含氧元素的质量为___________g.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】判断下列化学符号中数字“3”所表示的意义。将其序号填在相应的横线上:
①3H ②NH3 ③3CO2 ④Al3+ ⑤![]()
(1)表示1个分子中所含某原子的个数是_____;
(2)表示原子个数的是_____;
(3)表示分子个数的是_____;
(4)表示元素化合价的是_____;
(5)表示1个某离子所带电荷数的是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有铜与另一种金属的混合物粉末,另一种金属可能是镁、铁、锌中的一种,现欲测定其组成.
(查阅资料)(1)镁、铁、锌皆能与稀硫酸发生置换反应,且生成+2价的可溶性金属硫酸盐和氢气.
(2)相对原子质量:Mg﹣24、Fe﹣56、Zn﹣65
(实验步骤及数据)取该混合物粉末8.0g放入烧杯中,将140.0g 14.0%的稀硫酸分四次加入该烧杯中,充分反应后,测得剩余固体质量数据记录如下:
次数 | 1 | 2 | 3 | 4 |
加入稀硫酸的质量/g | 35.O | 35.0 | 35.O | 35.O |
剩余固体的质量/g | 6.8 | 5.6 | 4.4 | 4.2 |
通过计算(写出计算过程),求:
(1)该混合物粉末中铜的质量分数?
(2)该混合物粉末中另一金属为何种金属?
(3)第三次加入硫酸充分反应后,所得溶液中溶质的质量分数是多少?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】经过一年的学习,同学们认识了很多化学物质,它们在一定条件下可以转化或者相互反应。
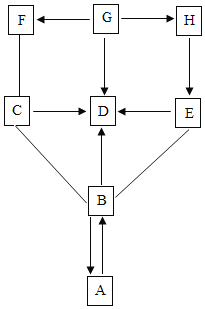
如图所示,A~H是初中化学所学的八种不同物质。“﹣”表示相连两物质之间能发生反应,“→”表示一种物质能转化成另一种物质。(部分反应物、生成物、反应条件已略去)
(1)已知A物质俗称纯碱,它的另一个俗称是_____。
(2)已知H是磁铁矿的主要成分Fe3O4,F是黑色固体,则F是__,G→H的化学反应基本类型是__。
(3)D是_____。
(4)写出B和C反应的化学方程式:_____。
(5)写出A→B反应的化学方程式:_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com