
【题目】已知:烧杯中的水均为100g,表是KC1、KNO3在不同温度时的溶解度。
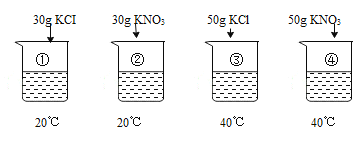
温度 | 20℃ | 40℃ |
KC1 | 34.0g | 40.0g |
KNO3 | 31.6g | 63.9g |
①~④所得溶液属于饱和溶液的是
A.①B.②C.③D.④
【答案】C
【解析】
A、20℃时,氯化钾的溶解度为34.0g,即100g水中最多溶解34g氯化钾,而烧杯①中是100g水中加入30g氯化钾,小于34.0g,所以形成的是20℃时的不饱和溶液。故A不符合和题意;
B、20℃时,硝酸钾的溶解度为31.6g,即100g水中最多溶解31.6g硝酸钾,而烧杯②中是100g水中加入30g硝酸钾,小于31.6g,所以形成的是20℃时的不饱和溶液。故B不符合和题意;
C、40℃时,氯化钾的溶解度为40g,即100g水中最多溶解40g氯化钾,而烧杯③中是100g水中加入50g氯化钾,大于40g,不能全部溶解,所以形成的是20℃时的饱和溶液。故C符合和题意;
D、40℃时,硝酸钾的溶解度为63.9g,即100g水中最多溶解63.9g硝酸钾,而烧杯④中是100g水中加入50g硝酸钾,小于63.9g,所以形成的是20℃时的不饱和溶液。故D不符合和题意;
故选C。


科目:初中化学 来源: 题型:
【题目】某化学活动兴趣小组的同学进行木炭还原 CuO 的探究实验,生成物是红色固体和无色气体。他们查阅资料后得知氧化亚铜(Cu2O)为红色固体,猜测反应物比例不同,产物也会不同。因此,生成物中有 CO2、CO和Cu,固体还可能有Cu2O。又知Cu2O能和常见的酸(HNO3除外)反应生成Cu2+和Cu。为此,请你和他们一起进行如下探究。
(1)探究气体中是否有CO气体。甲同学设计的方案是:先将气体通过足量的NaOH溶液,干燥后再通过灼热的CuO,未反应完的气体直接排放到空气中。
①甲同学实验后如果有______色固体生成,说明一定含有CO气体;
②上述实验方案中可选用的一种气体干燥剂是_________;
③甲同学设计的实验方案有无不足之处?若有,请你指出有何不良后果,并提出改进方案;若没有,该问不需作答。 _______。
(2)探究红色固体中是否有 Cu2O。
①在如下方法中:a 上网查询 b 实验 c 请教老师
你认为最能解决实际问题的方法是_______(填字母序号)。
②请你设计一个简便的实验方案,检验红色固体中是否有 Cu2O。
实验步骤 | _______ |
实验现象与结论 | _______ |
化学反应方程式 | _______ |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某兴趣小组发现铁钉生锈需要几天的时间,询问老师如何加快铁钉生锈的速度。
老师说氯化物可能加快铁钉生锈的速度。
【提出问题】氯化物对铁钉生锈有怎样的影响?
【查阅资料】
ⅰ.NaCl、CaCl2、CuCl2等由氯离子与金属离子构成的盐属于氯化物。
ⅱ.铜能与氧气反应,生成黑色的CuO。
ⅲ.CuO能与稀硫酸发生反应:CuO + H2SO4 ==== CuSO4 + H2O。
【进行实验、分析解释、获得结论】
实验1:探究氯化物对铁钉生锈速度的影响。
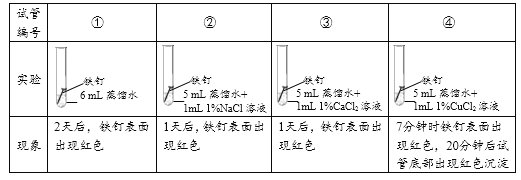
(1)对比实验①②③可以得到的结论是_________。
(2)小组同学认为,试管④中的红色沉淀可能是铁锈,也可能是铜。他们认为红色沉淀可能是铜的理由是__________(用化学方程式解释)。
实验2:探究试管④中红色沉淀的物质组成。
实验步骤 | 实验操作 | 实验现象 |
Ⅰ | 取出试管④中的铁钉,过滤剩余物,洗涤滤纸上的物质 | 固体为红色 |
Ⅱ | 将步骤Ⅰ所得红色固体加入试管中,再向试管中加入足量的___________ | 红色固体大部分溶解,溶液变为黄色 |
Ⅲ | 将步骤Ⅱ所得混合物过滤,洗涤、干燥滤纸上的固体后,置于石棉网上充分加热 | 红色固体变黑 |
Ⅳ | 向试管中加入步骤Ⅲ所得黑色固体,再加入足量稀硫酸 | 黑色固体全部溶解,溶液变为蓝色 |
(3)步骤Ⅱ中所加入的试剂是_________。
(4)步骤Ⅲ、Ⅳ的实验目的是_________。
(5)由实验2可得出结论:试管④中红色沉淀的物质组成是_________。
【反思与评价】
(6)结合实验1、2的结论,对于“氯化物对铁钉生锈速度的影响”,小组同学提出了进一步的假设:__。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】依据下图所示实验回答问题。
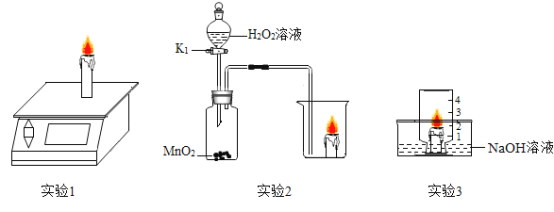
(1)实验1中,天平的示数将__________(变大、变小或不变)。
(2)实验2打开K1,烧杯中观察到的现象是__________。
(3)用实验3测定空气中氧气的含量,至液面不再变化时,上升到不足“1”处,可能的原因是__________。
(4)实验3可得出燃烧的条件之一是____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用如下图所示实验比较三种金属的活动性。

(1)若A为稀硫酸,实验观察到:①中有气泡产生,③中无明显变化,②中的现象为______。
(2)若A为硫酸铜溶液,实验观察到:①和②中金属表面均析出红色物质,③中无明显变化。写出②中发生反应的化学方程式______。
(3)上述实验可以证明金属活动性:B比______活泼。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某炼锌厂利用含ZnO的烟尘处理硫酸厂烟气中的SO2。
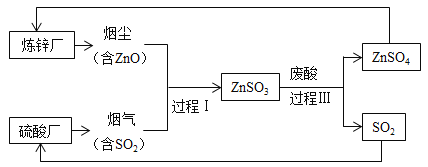
(1)下列物质中属于氧化物的是_______(填字母序号)。
A ZnO
B SO2
C ZnSO3
D ZnSO4
(2)ZnSO3 与废酸中的H2SO4反应的化学方程式为_______。
(3)过程II产生的SO2可用于制备硫酸,化学方程式可表示为:![]() 64g SO2完全反应理论上可制得H2SO4的质量为_______g。
64g SO2完全反应理论上可制得H2SO4的质量为_______g。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】废旧电池属于有害垃圾,其中锂电池主要回收工艺流程如下:
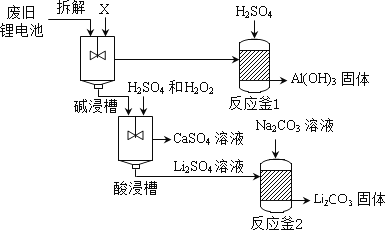
(1)碱浸槽中注入的X溶液,其pH>7,X是下列的______(填序号)。
A 稀盐酸 B 蒸馏水 C 氢氧化钠溶液
(2)反应釜2中发生复分解反应的化学方程式为_______。
(3)上述工艺回收到的产物有_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验是进行科学探究的重要手段。请回答下列问题。
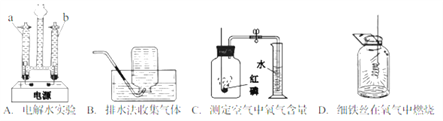
(1)实验 A 发生反应的化学方程式是_______,当电源接通一段时间后,a 管与 b 管中气体的体积比约为______。
(2)实验 B 集气瓶内装满水的目的是______.
(3)实验 C 通过______现象,可得出氧气约占空气体积 1/5 的结论。
(4)实验 D 中水的作用是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】过氧化钠(Na2O2)是一种淡黄色粉末状固体,能与水剧烈反应,生成氢氧化钠和氧气,小明利用过氧化钠进行制取氧气实验。
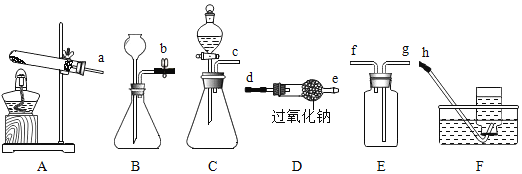
(1)小明要用过氧化钠制取并收集一瓶纯净、干燥的氧气,则上述导管口连接的顺序为_____。
(2)小明发现实验室有一瓶过氧化钠由于长期敞口暴露在空气中,已经变成了白色粉末状固体,该白色粉末状固体的主要成分是什么?_____(写化学式)。
(3)小明将过氧化钠固体放入硫酸铜溶液中,写出该反应总的化学反应方程式_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com