
【题目】某化学活动小组探究金属的反应规律。
(探究一)在室温条件下进行如图所示实验。
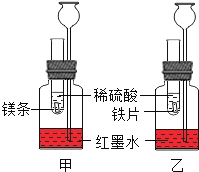
(1)已知:试管内的镁条和铁片表面均被打磨洁净,且形状、大小相同;同时加入等质量和等质量分数的稀硫酸,甲中反应方程式为___.
(2)若比较镁和铁的金属活动性,观察到的现象是___.
(3)若比较相同时间内镁、铁与稀硫酸反应放出热量的多少,长颈漏斗中的现象是___.
(4)若实验所用的金属均过量,则甲装置中产生的H2的质量___(填“大于”、“小于”或“等于”)乙装置中产生的H2质量。
(5)(探究二)在硫酸铜和硫酸亚铁的混合溶液中加入一定量的镁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,没有气泡产生。下列判断正确的是___.
A 滤出的固体中一定含有铜
B 滤出的固体可能含有铁和镁
C 滤液中可能含有硫酸铜
D 滤液中一定含有硫酸镁和硫酸亚铁。
【答案】Mg+H2SO4=MgSO4+H2↑ 镁和稀H2SO4反应产生气泡的速率比铁与稀H2SO4反应快 甲装置长颈漏斗中的液面比乙装置中高 等于 ACD
【解析】
(1)镁和硫酸反应生成硫酸镁和氢气,化学方程式为:Mg+H2SO4=MgSO4+H2↑;
(2)镁的活动性大于铁,因此观察到的现象是:镁和稀硫酸产生气泡的速率比铁和稀硫酸产生气泡的速率快;
(3)金属活动性越强,与酸反应越剧烈;镁的活动性大于铁,单位时间内镁比铁反应产生气体多,金属与酸反应放热,镁与酸反应放出热量多,长颈漏斗的液面上升的高;
(4)镁、铁与硫酸反应生成氢气的质量=硫酸中氢元素的质量;由题意可知:所用的金属均过量,说明稀硫酸中的硫酸溶质全部参加反应,而甲、乙装置中所加的稀硫酸是等质量和等质量分数,所以两装置中硫酸质量相等,则硫酸所含氢元素的质量相等,生成氢气的质量相等;
(5)A、根据金属活动顺序表知镁比铁活泼,铁比铜活泼,所以加入镁粉,首先镁粉和氯化铜溶液反应,置换出单质铜,所以滤出的固体中一定含有铜,故A正确;
B. 根据题意,向滤出的固体中滴加稀硫酸,没有气泡产生,说明固体中一定不含铁和镁,故B错误;
C. 因为加入的是一定量的镁粉,由B可知:镁粉不足,可能硫酸铜剩余,故C正确;
D. 由于,首先镁粉参与反应,所以滤液中一定有硫酸镁,固体中无铁,说明硫酸亚铁未反应,所以滤液中也一定有硫酸亚铁,故D正确。
故选:ACD。


 互动英语系列答案
互动英语系列答案科目:初中化学 来源: 题型:
【题目】A.B.C.D.E五种物质均为初中化学中所涉及的常见物质,它们存在如右图的转化关系,“→”表示可以向箭头所指方向一步转化,弧线表示两种物质间可以发生反应,C是常见气体,D是常见单质,(反应条件与其他物质均已略去)。

请回答下列问题:
(1)若A在常温下为液体,则C的化学式为__________;
(2)若A在常温下为气体,则C的化学式为_________;
(3)无论A在常温下为液体还是气体,B的化学式均为_________,D的化学式均为_________;
(4)写出A→E的化学方程式:_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是一种吸收废气中SO2并得到H2SO4的方法。下列说法不正确的是( )
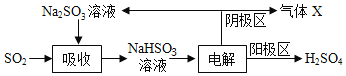
A.电解过程中电能转化为化学能
B.吸收时的反应为Na2SO3+SO2+H2O═2NaHSO3
C.阴极区产生的气体X是O2
D.该方法可减少酸雨的形成
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图1所示为硫的价类图(注:以化合价为纵坐标,以物质的类别为横坐标所绘制的图像叫价类图),每种物质中都有一种元素的化合价与纵坐标的数值对应,图中字母均表示初中化学中的常见物质,分析并回答下列问题:
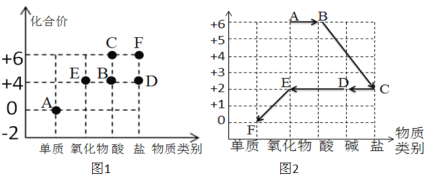
(1)写出如图中对应点表示物质的化学式:E点:_____;C点:_____。
(2)小丽同学根据上述规律也绘制了一个价类图(如图2),其中“→”表示物质间转化关系。已知A中氧元素的质量分数为60%,C、D、E、F均含有铜元素。请回答:
①“A+H2O=B”的反应属于基本反应类型中的_____;
②写出B和D反应生成C和水的化学方程式:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某兴趣小组进行粗盐提纯并配制NaCl溶液,请回答下列问题:
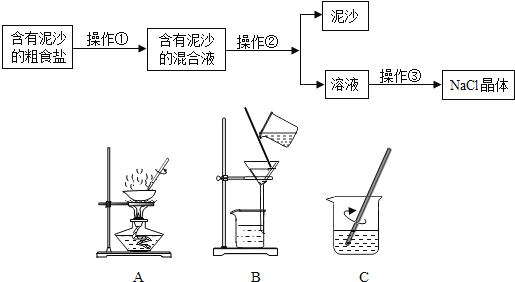
(1)操作①、②、③依次为图中的(填字母)_____、b、_____。
(2)若NaCl的产率偏低(产率=![]() ),则可能的原因是(填字母)_____。
),则可能的原因是(填字母)_____。
A 过滤时滤纸有破损
B 蒸发时有固体溅出
C 溶解含有泥沙的粗食盐时,加入的水量不足
(3)用上述实验所得NaCl晶体配制5%NaCl溶液50.0g,需称取NaCl_____g,配制时需要的玻璃仪器有烧杯、玻璃棒、滴管、_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知 A﹣H 均为初中化学常见的物质。其中 A、C 常温下是气体,且组成元素相同,B 是赤铁矿的主要成分,E 能用于改良酸性土壤,H 是紫红色金属。它们的相互转化关系如图所示(图中反应条件、部分生成物已略去)
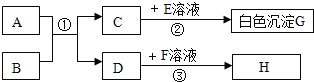
(1)物质 G 的化学式为____________。
(2)物质 H 的一种用途是用作_____________。
(3)反应③的基本反应类型是________________。
(4)反应①的化学方程式为_____________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】除去粗盐中难溶性杂质后,得到的固体中除了NaCl还含有少量的可溶性杂质MgCl2、CaCl2,某同学为除去可溶性杂质,将该固体加水溶解形成溶液A,并设计如下方案
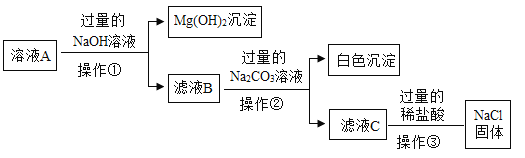
(1)操作③指的是________________
(2)方案中加入过量的NaOH溶液除去的离子是___________(填离子符号),加入Na2CO3溶液发生反应的化学方程式为_____________________
(3)在滤液C中加过量的稀盐酸是为了除去溶液中的___________
①NaOH ②Na2CO3 ③MgCl2 ④CaCl2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】白钨矿的主要成分是CaWO4,工业生产钨流程如下: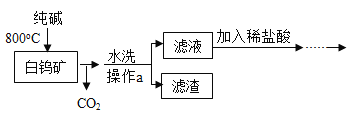
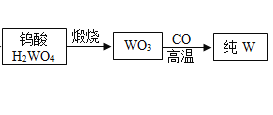
(1)水洗后,进行分离操作的名称是______,其中玻璃棒作用是______。
(2)白钨矿反应前需要进行粉碎,其目的是______。
(3)写出生成纯钨的化学方程式是______,写出金属钨的一种用途______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为研究“影响金属与盐酸反应剧烈程度的因素”,兴趣小组同学进行如下探究。
(1)(提出问题)金属与盐酸反应剧烈程度受哪些因素的影响?
(作出假设)I. 可能与金属本身的性质有关;II. 可能与盐酸的浓度有关;III. ________(请你填写一个合理的猜想)。
(2)(实验探究)实验所用金属均已用砂纸打磨。
①实验一:为探究猜想I,小红同学分别在两支试管中放入相同质量的锌和铁,然后分别加入同体积、同浓度的稀盐酸,观察到放锌的试管中立即产生大量气泡,放铁的试管中只产生少量气泡,由此得出结论:金属活动性 Zn>Fe。你认为实验一方案是否合理________________________,理由是______________________。
②实验二:为探究猜想 II,小军同学利用下列下图装置进行对照实验,做了等质量且过量的锌片分别与等体积、浓度为5%、15%的稀盐酸反应。其中注射器的作用是____;该装置气密性的检查方法是___________________ 。
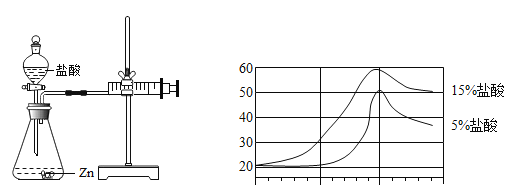
③实验三:小军同学还用压强传感器替换注射器进行数字化实验,测得两次实验压强随时间的 变化关系曲线如上述右图所示。请你根据该图中信息得出两条合理结论:_________________________________;___________________ 。
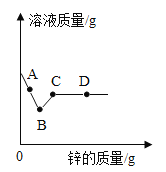
(拓展延伸)附加分:若正确回答下列小题,将获得 4 分的奖励,但化学试卷总分不超过 60 分。
(3)已知一种金属加入到比它弱的两种金属盐溶液的混合液中,先置换出最弱的金属。小敏同学向一定质量的硝酸银和硝 酸铜的混合溶液中加入锌粉,溶液质量与加入锌的质量关系如图所示。那么,在 A 点时,溶液里含的盐有__________种;BC 段发生的化学反应方程式为_______;D 点得到的固体的成分为___________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com