
 牙膏是生活必需品,某兴趣小组对某品牌市售牙膏展开如下探究,请回答问题:
牙膏是生活必需品,某兴趣小组对某品牌市售牙膏展开如下探究,请回答问题:| 实验编号 | 1 | 2 | 3 |
| 实验前(g) | 2.00 | 2.00 | 2.00 |
| 实验后(g) | 0.43 | 0.44 | 0.45 |
| 0.44+0.43+0.45 |
| 3 |
| 0.44g |
| 2.00g |


 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:初中化学 来源: 题型:
A、 凉拌黄瓜 凉拌黄瓜 |
B、 红烧肥肉 红烧肥肉 |
C、 玉米窝头 玉米窝头 |
D、 清蒸螃蟹 清蒸螃蟹 |
查看答案和解析>>
科目:初中化学 来源: 题型:
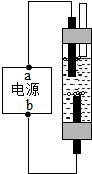 水是生命之源,请回答下列有关水的问题:
水是生命之源,请回答下列有关水的问题:
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
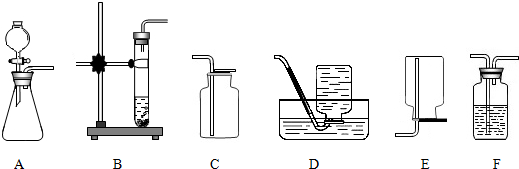
查看答案和解析>>
科目:初中化学 来源: 题型:
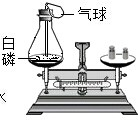 小明用如图所示实验来探究质量守恒定律.反应前天平平衡,他取下此装置(装置气密性良好),将瓶塞上的铁丝在酒精灯上烧红后,接触引燃白磷,并马上塞紧瓶塞.待充分反应后,气球膨胀,立即将装置放回天平左盘,此时他发现天平的指针向右偏转了.请问:
小明用如图所示实验来探究质量守恒定律.反应前天平平衡,他取下此装置(装置气密性良好),将瓶塞上的铁丝在酒精灯上烧红后,接触引燃白磷,并马上塞紧瓶塞.待充分反应后,气球膨胀,立即将装置放回天平左盘,此时他发现天平的指针向右偏转了.请问:查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验步骤及现象 | 实验结论(填离子符号) |
| 取废水样品观察,呈无色 | 废水中不含 |
| 测所取废水样品的pH,pH=13 | 废水中含较多的 |
| 向废水样品中加入过量的稀盐酸,没有气泡产生 | 废水中不含 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com