
 雨、雪在形成和降落过程中吸收、溶解了空气中SO2及氮氧化物等物质,形成了pH小于5.6的降水称为酸雨,请回答下列有关酸雨的问题:
雨、雪在形成和降落过程中吸收、溶解了空气中SO2及氮氧化物等物质,形成了pH小于5.6的降水称为酸雨,请回答下列有关酸雨的问题:分析 (1)依据酸雨是pH小于5.6的降水可知要想证明是否是酸雨则要测定溶液的pH,据此分析即可.
(2)依据题干信息结合设计的实验可知,只要是证明亚硫酸的溶液pH能小于5.6即可完成相关的验证.
解答 解:(1)因为酸雨是pH小于5.6的降水,所以要想证明是否是酸雨则要测定溶液的pH.
A、蓝色石蕊试纸是检验溶液酸性时常用的试纸,不能准确测量溶液酸碱度;
B、紫色石蕊溶液只能检验溶液的酸碱性,不能检测溶液的酸碱度;
C、无色酚酞试剂只能检验溶液的酸碱性,不能检测溶液的酸碱度
D、pH试纸能较准确地测量溶液的酸碱强弱的程度,所以检验某地是否下酸雨可利用pH试纸进行测量;
(2)二氧化硫溶于水会生成亚硫酸,二氧化碳溶于水会生成碳酸,而CO2的饱和溶液常温下pH不小于 5.6,所以要想证明二氧化硫是形成酸雨的主要成分,只要证明实验中亚硫酸的溶液pH能小于5.6即可.
答案:(1)D (2)实验后水溶液的PH值 PH值小于5.6
点评 此题是一道与酸雨相关的考查题,涉及到酸雨的形成及实验验证,借助题干信息结合相关的所学知识是解题的关键所在.


科目:初中化学 来源: 题型:选择题
| A. | 组成:1个二氧化碳分子比1个一氧化碳分子多1个氧原子 | |
| B. | 性质:都是无色无味的气体;都能溶于水,都能燃烧 | |
| C. | 用途:CO2用于灭火,“干冰”可用于人工降雨等;CO可作燃料、冶炼金属等 | |
| D. | 危害:CO2会造成“温室效应”;CO极易与血液中的血红蛋白结合引起中毒 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 海水密度/(g•mL-1) | CaSO4 | NaCl | MgCl2 | MgSO4 | NaBr |
| 1.13 | 0.56 | ||||
| 1.20 | 0.91 | ||||
| 1.21 | 0.05 | 3.26 | 0.004 | 0.008 | |
| 1.22 | 0.015 | 9.65 | 0.01 | 0.04 | |
| 1.26 | 0.01 | 2.64 | 0.02 | 0.02 | 0.04 |
| 1.31 | 1.40 | 0.54 | 0.03 | 0.06 |

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 混合物:空气 粗盐 牛奶 | B. | 盐:氯化钙 硫酸 硝酸钾 | ||
| C. | 氧化物:MgO P2O5 KClO3 | D. | 单质:铝 金刚石 氯化氢 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 序号 | 温度/℃ | 水的质量/克 | 所加硝酸钾的质量/克 | 所得溶液的质量/克 |
| ① | 28 | 10 | 4 | 14 |
| ② | 28 | 10 | 6 | 14 |
| ③ | 60 | 10 | 8 | 18 |
| A. | ①②所得溶液溶质的质量分数相等 | |
| B. | ③所得溶液一定是硝酸钾的饱和溶液 | |
| C. | 28℃时10克水中最多能溶解硝酸钾4克 | |
| D. | 60℃时等质量水中能溶解的硝酸钾比28℃时多 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Fe、X、Cu | B. | X、Fe、Cu | C. | Fe、Cu、X | D. | Cu、X、Fe |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
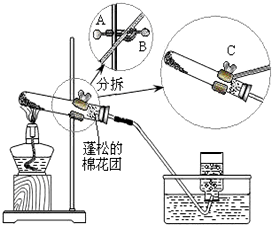 某同学做“高锰酸钾制取氧气”的实验过程如下:
某同学做“高锰酸钾制取氧气”的实验过程如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com