

| ||
| ||


科目:初中化学 来源: 题型:
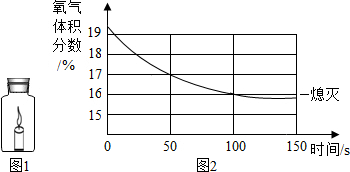 蜡烛(足量)在如图1密闭的集气瓶内燃烧至熄灭,用仪器测出瓶内氧气含量的变化如图2所示.下列判断正确的是( )
蜡烛(足量)在如图1密闭的集气瓶内燃烧至熄灭,用仪器测出瓶内氧气含量的变化如图2所示.下列判断正确的是( )| A、蜡烛燃烧前瓶内只有氧气 |
| B、蜡烛熄灭后瓶内只剩二氧化碳气体 |
| C、反应后有气体生成所以瓶内物质总质量减小 |
| D、氧气浓度小于一定值时,蜡烛无法燃烧 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
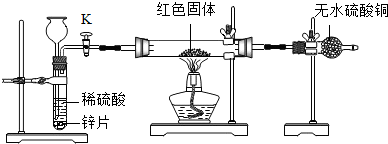
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验步骤 | 现象 | 结论 |
| (1)取少量红色固体于一支洁净的试管中,加入稀盐酸 | 猜想一不成立 | |
| (2)①用尖嘴导管将气体导出并引燃,同时在上方放一块干冷的玻璃片 ②取少量红色固体于一支洁净的试管中,加入稀硝酸 |
①该气体能燃烧,且玻璃片上有 ②红色固体溶解,得到蓝色溶液同时看到试管上部有红棕色气体产生 |
猜想二成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
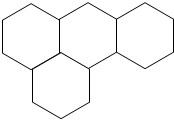 用四个六边形表示A(碳酸钠溶液)、B(硝酸银溶液)、C(氯化钡溶液)、D(铁粉)四种物质,用相邻的六边形有共同的边表示两种物质可以发生反应,请回答下列问题:
用四个六边形表示A(碳酸钠溶液)、B(硝酸银溶液)、C(氯化钡溶液)、D(铁粉)四种物质,用相邻的六边形有共同的边表示两种物质可以发生反应,请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:
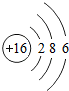 在宏观、微观和符号之间建立联系是化学学科的特点
在宏观、微观和符号之间建立联系是化学学科的特点 ”表示一个氯原子,则“
”表示一个氯原子,则“ ”表示
”表示查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com