
| 实验操作 | 实验现象 | 实验结论 |
| 实验①:取少量滤液于试管中,加入适量的纯碱溶液,振荡. | 无明显现象 | 猜想Ⅱ不成立 |
| 实验②取少量滤液于试管中,加入适量的氢氧化钡溶液,振荡 | 产生白色沉淀 | 猜想Ⅲ成立 |
分析 (1)碱、盐,盐、盐反应时反应物均须可溶,第一个反应:CuSO4溶液与NaOH溶液反应生成氢氧化铜沉淀和硫酸钠溶液,第二个反应:CuSO4溶液与BaCl2溶液反应生成硫酸钡沉淀和氯化铜,反应后废液中一定有氯化铜,废液混合后过滤所得滤液为无色,说明第一个反应中NaOH溶液过量,将氯化铜反应消耗完;
(2)滴入 紫色石蕊试液,石蕊溶液仍为紫色,说明溶液显中性;
【作出猜想】最终滤液无色,说明溶液中一定不含铜离子,滤液呈中性,说明氢氧化钠与氯化铜恰好反应,生成氯化钠,第一个反应生成硫酸钠溶液,所以滤液中的溶质可能是氯化钠和硫酸钠;
若第二个反应中氯化钡过量,则其废液中有氯化钡、氯化铜,若氯化钡与第一个反应生成的硫酸钠恰好反应,氢氧化钠与氯化铜恰好反应,则滤液中溶质为氯化钠;
若第二个反应中氯化钡过量,则其废液中有氯化钡、氯化铜,若氯化钡与第一个反应生成的硫酸钠反应后有剩余,氢氧化钠与氯化铜恰好反应,则滤液中溶质为氯化钠和氯化钡,再结合实验操作的现象和结论分析猜想的内容;
【实验探究】实验①:取少量滤液于试管中,加入适量的纯碱溶液,无现象,说明滤液中无钡离子,则猜想Ⅱ是NaCl、BaCl2;
加入某物质能产生白色沉淀且最后溶液能使酚酞变红,说明是加入的碱性溶液,能与碱反应生成沉淀的是硫酸钠,所以猜想Ⅲ是NaCl、Na2SO4,硫酸钠可与氢氧化钡溶液反应生成硫酸钡沉淀,据此分析解答;
【交流拓展】据前面的金属可将排在其后面的金属从其盐溶液中置换出来进行回答.
解答 解:(1)第一个反应:CuSO4溶液与NaOH溶液反应生成氢氧化铜沉淀和硫酸钠溶液,第二个反应:CuSO4溶液与BaCl2溶液反应生成硫酸钡沉淀和氯化铜,反应后废液中一定有氯化铜和硫酸钠,废液混合后过滤所得滤液为无色,说明第一个反应中NaOH溶液过量,与氯化铜反应生成氢氧化铜沉淀和氯化钠,方程式是CuCl2+2NaOH=Cu(OH)2↓+2 NaCl;
(2)滴入紫色石蕊试液,石蕊溶液仍为紫色,说明溶液显中性;
【作出猜想】最终滤液无色,说明溶液中一定不含铜离子,滤液呈中性,说明氢氧化钠与氯化铜恰好反应,生成氯化钠,第一个反应生成硫酸钠溶液,所以滤液中的溶质可能是氯化钠和硫酸钠;
若第二个反应中氯化钡过量,则其废液中有氯化钡、氯化铜,若氯化钡与第一个反应生成的硫酸钠恰好反应,氢氧化钠与氯化铜恰好反应,则滤液中溶质为氯化钠;
若第二个反应中氯化钡过量,则其废液中有氯化钡、氯化铜,若氯化钡与第一个反应生成的硫酸钠反应后仍有剩余,氢氧化钠与氯化铜恰好反应,则滤液中溶质为氯化钠和氯化钡;
实验①:取少量滤液于试管中,加入适量的纯碱溶液,无现象,说明滤液中无钡离子,因为碳酸钠可与氯化钡反应生成碳酸钡沉淀,与氯化钠、硫酸钠不反应,则猜想Ⅱ是NaCl、BaCl2;
加入某物质能产生白色沉淀且最后溶液能使酚酞变红,说明是加入的碱性溶液,能与碱反应生成沉淀的是硫酸钠,碱与氯化钠不反应,所以猜想Ⅲ是NaCl、Na2SO4,猜想Ⅰ是NaCl;
【实验探究】硫酸钠可与氢氧化钡溶液反应生成硫酸钡沉淀,所以实验②可取少量滤液于试管中,加入适量的氢氧化钡溶液,振荡;
【交流拓展】锌排在铜前面,且反应后溶液为无色,故可选锌,铝、镁也可;
故答案为:(1)CuCl2+2NaOH=Cu(OH)2↓+2 NaCl;
(2)中;
【作出猜想】NaCl;NaCl、BaCl2;NaCl、Na2SO4;
【实验探究】取少量滤液于试管中,加入适量的氢氧化钡溶液,振荡;
【反思拓展】锌(合理均可).
点评 本题主要考查了酸碱盐的化学性质,复分解反应条件的应用,以及应用知识分析和解决问题的能力,有一定难度,要依据物质间的反应细心分析解答.


科目:初中化学 来源: 题型:选择题
| A. | 电子层数一定相差2 | |
| B. | 都容易得(或失)电子,形成阴(或阳)离子 | |
| C. | 最外层电子数一定相等 | |
| D. | 质子数相差8,中子数也可能相差8 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
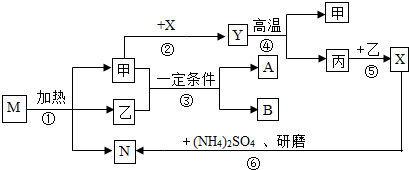
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
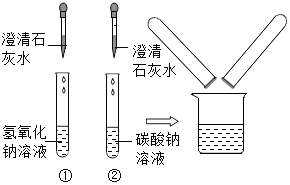 鉴别碳酸钠溶液和氢氧化钠溶液的实验结束后,小红同学将①、②两支试管中的废液倒入同一个干净的烧杯中,看到废液浑浊,就对废液进行了过滤,小红等几位同学对滤液的成分又进行了探究.
鉴别碳酸钠溶液和氢氧化钠溶液的实验结束后,小红同学将①、②两支试管中的废液倒入同一个干净的烧杯中,看到废液浑浊,就对废液进行了过滤,小红等几位同学对滤液的成分又进行了探究.| 实验步骤 | 实验现象 | 实验结论 |
| 取样于试管中,滴入几滴稀盐酸 | 没有气泡产生 | 自己的猜想不成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验操作 | 实验现象 | 实验结论 |
| 1、取少量样品于一支洁净试管中,加入足量稀硫酸. | 有气泡产生 | 猜想I不成立. |
| 2、取少量样品于另一只洁净试管中,向其中加入过量的BaCl2溶液,过滤,向所得沉淀中加入足量稀硝酸. | 先产生白色沉淀;加入稀硝酸后,有气泡产生,白色沉淀部分溶解. | 猜想Ⅲ成立. |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 二氧化硫的产生主要原因是煤的大量燃烧 | |
| B. | 海底埋藏着大量的可燃冰,它不可能成为未来的新能源 | |
| C. | 氢气极易燃烧,燃烧的产物是水,被认为是最淸洁的燃料 | |
| D. | 化石燃料面临被耗尽的危险,人类正在利用和开发新的能源.如太阳能、风能、地热能等 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 巢湖市位于合肥南部,瀕临长江,是全国五大淡水湖之一.巢湖的水污染问题很严重,尤其是夏季的蓝藻爆发对工农业生产和居民生活产生很大的影响.
巢湖市位于合肥南部,瀕临长江,是全国五大淡水湖之一.巢湖的水污染问题很严重,尤其是夏季的蓝藻爆发对工农业生产和居民生活产生很大的影响. 查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 互溶的液体混合物可用分液方法分离 | |
| B. | 互不相溶的液态混合物可用分液方法分离 | |
| C. | 沸点不同的液体混合物可用蒸馏方法分离 | |
| D. | 溶于水的固体与难溶于水的固体形成的混合物可用溶解、过滤、蒸发的方法分离 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com