
| 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
| 烧杯与残留物总质量/g | 241.2 | 332.4 | 未测 | 514.8 | 614.8 |
| 100 |
| x |
| 44 |
| 35.2g |
| 73 |
| y |
| 44 |
| 35.2g |
| 80g |
| 100g |
| 58.4g |
| 400g |


科目:初中化学 来源: 题型:
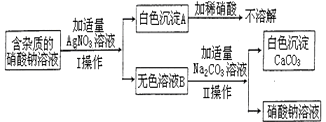 为了确定某含杂质的硝酸钠溶液中所含杂质的成分,某同学设计了如图实验:请回答下列问题:
为了确定某含杂质的硝酸钠溶液中所含杂质的成分,某同学设计了如图实验:请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:
| Cr | Zn | Cu | |
| 与稀硫酸反应现象 | 放出气泡速率缓慢 | 放出气泡速率较快 | 无明显现象 |

查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
| ||
| 实验操作 | 实验现象 | 实验结论 |
| 取少量固体剩余物于试管中,向其中加入足量的稀硫酸. | (1)固体部分溶解,溶液为无色. | 假设①成立. |
| (2)固体部分溶解, |
假设②成立. | |
| (3)固体部分溶解, |
假设③成立. |
| 实验组别 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | V |
| 药 品 | Al | Fe | Ag | Al | Cu |
| CuO | CuO | CuO | Fe2O3 | Fe2O3 | |
| 相同条件下是否反应 | 是 | 是 | 否 | 是 | 否 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com