
【题目】碳酸镁水合物是制备镁产品的中间体。
(制取MgCO33H2O)工业上从弱碱性卤水(主要成分为MgCl2)中获取MgCO33H2O的方法如图:
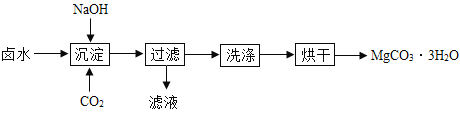
(1)沉淀过程的化学方程式为:MgCl2+CO2+2NaOH+2H2O═MgCO33H2O↓+2___。
(2)沉淀过程的pH随时间的变化如图所示,沉淀过程的操作为____(填标号)。
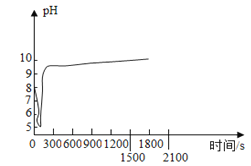
a 向卤水中滴加NaOH溶液,同时通入CO2
b 向NaOH溶液中滴加卤水,同时通入CO2
c 向卤水中通入CO2至饱和,然后滴加NaOH溶液,同时继续通入CO2
d 向NaOH溶液中通入CO2至饱和,然后滴加卤水,同时继续通入CO2
(3)沉淀过程的溶液中镁离子含量随时间的变化如图所示,不同温度下所得到沉淀产物如下表所示。
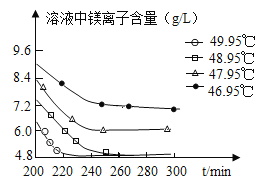
温度(℃) | 产物 |
46.95 | MgCO33H2O |
47.95 | MgCO33H2O |
48.95 | MgCO33H2O |
49.95 | Mg5(OH)2(CO3)44H2O |
则沉淀过程选择的温度为____℃,理由是此温度下,Mg2+沉淀的速率较快,沉淀效率较高,且不会生成其它沉淀。
(测定MgCO33H2O的纯度)
(查阅资料)
1.碱石灰是CaO与NaOH的固体混合物。
2.MgCO33H2O+H2SO4=MgSO4+CO2↑+4H2O。
3.Mg5(OH)2(CO3)44H2O也可以表示为Mg(OH)24MgCO34H2O,其相对分子质量为466,能与硫酸反应生成CO2。
4.Ba(OH)2能溶于水
(实验步骤)
利用如下图所示装置(图中夹持仪器略去)进行实验,以确定MgCO33H2O的纯度。
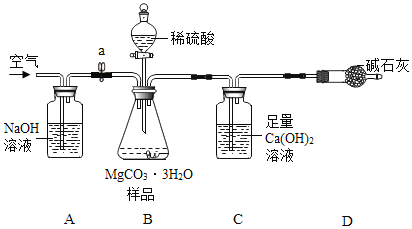
依据实验过程回答下列问题:
(1)A中NaOH溶液的作用是________。
(2)C装置中反应生成CaCO3的化学方程式为_____;D中碱石灰的作用为___。
(3)下列各项措施中,不能提高测定准确度的是____(填标号)。
a 在加入硫酸之前,应排净装置内的CO2气体
b 为了缩短实验时间,快速滴加硫酸
c 在A~B之间增添盛有浓硫酸的洗气装置
d 在C装置左侧导管末端增添多孔球泡
(4)小明认为应将C装置中澄清石灰水换成Ba(OH)2溶液,理由一:___,使CO2被吸收的更完全;理由二: BaCO3的相对分子质量比CaCO3大,等质量的MgCO33H2O生成的BaCO3质量大于CaCO
(5)实验中准确称取15.0g样品三份,进行三次测定,测得生成CaCO3沉淀的平均质量为10.0g。请计算样品中MgCO33H2O的纯度(写出计算过程)____。
(6)若获取MgCO33H2O的样品中含有少量Mg5(OH)2(CO3)44H2O,则样品中MgCO33H2O的纯度____(填“偏大”“不变”或“偏小”)。
【答案】NaCl c 48.95 吸收空气中的二氧化碳气体,防止干扰定量实验 CO2+Ca(OH)2=CaCO3↓+H2O 防止空气中的水和二氧化碳气体进入装置C,干扰实验 bc 氢氧化钡的溶解度明显大于氢氧化钙 92% 偏大
【解析】
1)该反应符合质量守恒定律,反应物比生成物多2个钠原子和2个氯原子,则沉淀过程的化学方程式为MgCl2+CO2+2NaOH+2H2O═MgCO33H2O↓+2NaCl。
(2)沉淀过程的pH随时间的变化为:溶液先有弱碱性变为酸性,再有酸性变为碱性,沉淀过程的操作为:向卤水中通入CO2至饱和,二氧化碳与酸生成碳酸,使混合溶液变为酸性,然后滴加NaOH溶液(具有强碱性),使混合溶液变为碱性,同时继续通入CO2,溶液的pH值基本不变;
故选:c;
(3)沉淀过程选择的温度为48.95℃,理由是:此温度下,Mg2+沉淀的速率较快,沉淀效率较高,且不会生成其它沉淀。大于48.95℃时,会产生Mg5(OH)2(CO3)44H2O;小于48.95℃时,溶液中含有大量的镁离子,生成MgCO33H2O较少;
依据实验过程回答下列问题:
(1)A中NaOH溶液的作用是:吸收空气中的二氧化碳气体,防止干扰定量实验;
(2)C装置中二氧化碳与氢氧化钙反应生成碳酸钙和水的化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O;D中碱石灰的作用为:防止空气中的水和二氧化碳气体进入装置C,干扰实验;
(3)下列各项措施中,不能提高测定准确度的是:
a 在加入硫酸之前,应排净装置内的CO2气体,减少空气中二氧化碳对实验的影响;能提高测定准确度;
b 为了缩短实验时间,快速滴加硫酸,会导致二氧化碳气体产生过快,导致反应不充分;不能提高测定准确度;
c 在A~B之间增添盛有浓硫酸的洗气装置物作用,因为B装置中有大量的水,且C装置不吸收水;不能提高测定准确度;
d 在C装置左侧导管末端增添多孔球泡,可以观察产生二氧化碳的速率,从而指导控制装置B,是产生的二氧化碳气体能充分与氢氧化钙溶液反应,能提高测定准确度;
故选:bc;
(4)小明认为应将C装置中澄清石灰水换成Ba(OH)2溶液,理由一:氢氧化钡的溶解度明显大于氢氧化钙,使CO2被吸收的更完全;理由二: BaCO3的相对分子质量比CaCO3大,等质量的MgCO33H2O生成的BaCO3质量大于CaCO3质量,实验时相对误差小。
(5)解:设参加反应二氧化碳的质量为x。
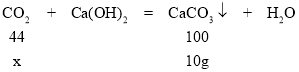
![]() x=4.4g
x=4.4g
设:品中MgCO33H2O的质量为y。
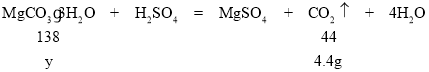
![]() y=13.8g
y=13.8g
品中MgCO33H2O的纯度=![]() ;
;
(6)若获取MgCO33H2O的样品中含有少量Mg5(OH)2(CO3)44H2O,则样品中MgCO33H2O的纯度偏大。因为MgCO33H2O中镁元素质量分数=![]() ;而碳元素的质量分数
;而碳元素的质量分数![]() ;
;
;Mg5(OH)2(CO3)44H2O中镁元素的质量分数=![]() ,而碳元素的质量分数
,而碳元素的质量分数![]() ;所以等质量的Mg5(OH)2(CO3)44H2O比MgCO33H2O产生碳酸钙沉淀多,所以计算的纯度偏大。
;所以等质量的Mg5(OH)2(CO3)44H2O比MgCO33H2O产生碳酸钙沉淀多,所以计算的纯度偏大。


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:初中化学 来源: 题型:
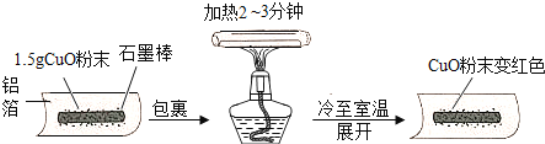
【题目】.某兴趣小组在做完碳还原氧化铜实验后,进行了如图的探究:
[猜想]把氧化铜还原成铜的物质是:Ⅰ.石墨棒;Ⅱ.________.
[实验]用天平称量1.5g氧化铜粉末,直接用铝箔纸包裹.按上述操作步骤实验,黑色粉末________,那么猜想Ⅱ不成立.
[结论]石墨棒能使氧化铜还原成铜,该反应的化学方程式为________.
[改进]把石墨棒换成铝粉,重复上述操作,又获成功.那么,称取等量的铝粉并进行同样的操作,其目的是________.改进后的实验证明,金属铝与铜活动性顺序是________,该反应的化学方程式为________.[拓展]如果使用复印机的“碳粉”代替石墨棒还原氧化铜,效果更好.联想在空气中灼热的铁丝不能燃烧,而铁粉能燃烧,其原因是________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组对酸、碱、盐的部分性质进行探究。
(探究一)氢氧化钠与二氧化碳反应
甲同学设计实验方案如图1所示:

(1)图1中的实验现象为_____________,甲同学由此判断氢氧化钠和二氧化碳发生了反应。
(2)小组内其他同学认为甲同学方案不完善,理由是________________。并对实验进行了改进,改进装置如图2所示:在A处放置适量干冰,B处装入适量的浓NaOH溶液,量筒中加入足量的稀盐酸,实验过程中,观察到量筒中有气泡冒出,原因是______________。一段时间后,观察到的现象是:①量筒中溶液倒吸入B中;②_________________,说明二氧化碳确实与氢氧化钠发生了反应。
(探究二)氢氧化钠和盐酸发生中和反应时放出热量
乙同学向一定量10﹪的氢氧化钠溶液中滴加10﹪的盐酸,滴加过程中温度变化如下表:
加入盐酸体积V/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
混合溶液温度T/℃ | 15.2 | 19.6 | 22.0 | 26.0 | 28.2 | 26.7 | 25.7 | 24.7 | 23.7 | 22.9 |
(3)反应的化学方程式为________________。
(4)根据表中数据分析混合溶液温度变化的原因_______________。
(5)小组内其他同学提出“将10﹪的盐酸直接滴入氢氧化钠固体中也能得出相同结论”,你认为是否合理并说明理由_______________。
(6)丙同学将甲同学和乙同学实验后的溶液混合,未发现明显现象。现将混合液中的氯化钠进行提纯,具体的操作为____________。
(探究三)碳酸钠溶液与稀盐酸的分步反应
(查阅资料)向碳酸钠溶液中逐滴加入稀盐酸的反应是分步反应,第一步反应生成碳酸氢钠和氯化钠,当碳酸钠反应完后才发生第二步反应。
丁同学向106g质量分数为10﹪的碳酸钠溶液中逐滴加入质量分数为3.65﹪的稀盐酸,生成二氧化碳的质量变化如图3所示(不考虑CO2的溶解)。
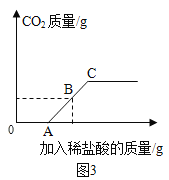
(7)A→Cspan>段发生反应的化学方程式为________________。
(8)若B点横坐标为150,则其纵坐标为______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】一定条件下,下列物质在密闭容器内充分反应,测得反应前后各物质的质量如下:
纯净物 | 乙醇 | 氧气 | 二氧化碳 | 水 | X |
反应前质量/g | 2.3 | 4 | 0 | 0 | 0 |
反应后质量/g | 0 | 0 | 2.2 | 2.7 | 待测 |
A.反应后X的质量为1.5g B.X中一定含有碳元素和氧元素
C.X中一定含有碳元素和氢元素 D.X中两种元素的质量比是1:1
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙三种固体物质的溶解度曲线如图所示。下列说法不正确的是
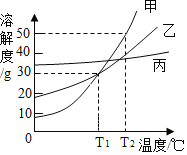
A.T2℃时,取等质量的甲、乙分别配制成饱和溶液,所需水的质量:甲>乙
B.T2℃时,将甲、乙的饱和溶液均降温到T1℃,得到的溶液仍饱和
C.若甲中混有少量的丙,可采用降温结晶的方法提纯甲
D.T1℃时,甲、乙各30g分别加入100g水中,均形成饱和溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室通常用澄清石灰水检验二氧化碳的存在,若二氧化碳过量,会进一步与碳酸 钙、水反应生成易溶于水的碳酸氢钙(CaCO3+H2O+CO2═Ca(HCO3)2)。若向含有 Ca(OH)2 7.4g 的澄清石灰水里缓缓通入一定量的二氧化碳,反应后若生成 5g 沉淀,则通 入二氧化碳的质量可能为( )
A.2.2gB.4.4gC.6.6gD.13.2g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图像能正确反映对应的实验操作的是
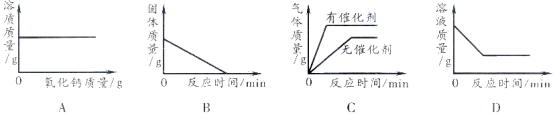
A.向一定量的饱和石灰水中加入氧化钙
B.加热一定量高锰酸钾固体产生氧气
C.用一定量的双氧水制取氧气
D.向一定量的硝酸银溶液中插入铜
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A~H是初中化学常见物质,已知B为黑色固体,D为红色固体单质,F为红色固体,他们的转化关系如图所示。请回答下列题:
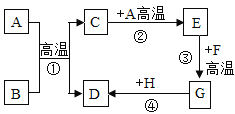
(1)物质B、E的化学式分别为、_____________。
(2)反应③的化学方程式分别为________,反应③在实际生产中的应用是________。
(3)反应①、③的基本反应类型是否相同?_____________(填“相同”或“不同”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两小组同学分别用下图所示装置(夹持仪器已略去)做兴趣实验。
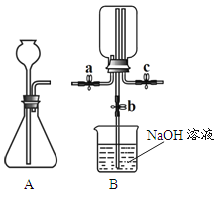
(1)甲组实验:
① 在A装置的锥形瓶中加入大理石,向长颈漏斗中注入稀盐酸,A中反应的化学方程式为_____。
② 连接A、B装置,打开a、c,关闭b,向B中集气瓶内充入气体,检验集气瓶中气体已收集满的方法是_____。
③ 关闭a、c,打开b,用冷毛巾捂住B中集气瓶,一段时间后,观察到B装置中的现象是_____, B中反应的化学方程式为_____。
(2)乙组实验:
【资料】氯化氢气体和氨气均极易溶于水,且两者反应生成白色固体氯化铵(NH4Cl)。
在c右端的导管口套一个气球,在A的锥形瓶中放入浓盐酸,向长颈漏斗中注入浓硫酸,有HCl气体产生,待A中的空气被排净后,连接A、B装置,打开a、c,关闭b,气球微微鼓起。产生HCl气体的原因是_____。
② 关闭a,将A中的药品替换为NaOH固体和浓氨水,待A中的空气被排净后,连接A、B装置,打开a,一段时间后关闭a,B中集气瓶内有白烟产生。冷却至室温后气球恢复原状。关闭c打开b,B中导管内的液面无任何变化。产生上述现象的原因是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com