
 我国化学家侯德榜于1923年研制成功的“联合制碱法(又称侯氏制碱法)”的主要特点是:在浓氨水(NH3极易溶于水)中通入足量的二氧化碳生成一种盐,然后在此溶液中加入细的食盐粉末,由于NaHCO3在该状态下溶解度很小,呈晶体析出,同时由于大部分酸式碳酸盐加热容易转变为正盐,所以将析出的NaHCO3加热分解即可得纯碱,请回答:
我国化学家侯德榜于1923年研制成功的“联合制碱法(又称侯氏制碱法)”的主要特点是:在浓氨水(NH3极易溶于水)中通入足量的二氧化碳生成一种盐,然后在此溶液中加入细的食盐粉末,由于NaHCO3在该状态下溶解度很小,呈晶体析出,同时由于大部分酸式碳酸盐加热容易转变为正盐,所以将析出的NaHCO3加热分解即可得纯碱,请回答:分析 (1)①根据浓氨水和二氧化碳反应生成碳酸氢铵进行分析,
②根据碳酸氢钠的溶解度很小,以晶体形式析出,两者交换成分进反应,
③根据碳酸氢钠受热分解出碳酸钠来判断.
书写方程式时必须配平,注明反应条件,标出气体或沉淀符号.
(2)根据信息“在浓氨水中通入足量的二氧化碳生成一种盐,然后在此盐溶液中加入细的食盐粉末”判断并回答.根据信息“NH4HCO3与NaCl的反应产物是碳酸氢钠和氯化铵,及将析出的碳酸氢钠加热分解即可制得纯碱”判断并回答.根据生产过程发生的反应,以及各反应类型的定义和特点回答;
(3)A、根据生产过程中所涉及物质的来源和去向判断.
B、根据氯化铵的组成判断.
C、根据碳酸氢钠分解制纯碱的条件判断.
D、根据氯化铵的用途判断.
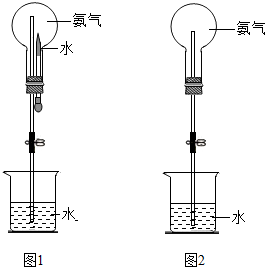
(4)利用氨气极易溶于水,形成压强差而形成喷泉,加热时烧瓶内压强增大,气体体积膨胀,当氨气与水接触时会导致烧瓶内压强减小.
(5)以氯化钙可以和碳酸氢钠反应生成白色沉淀碳酸钙、氯化钠、水和二氧化碳,写出化学方程式.
解答 解:(1)①浓氨水和二氧化碳反应生成碳酸氢铵,故答案为:NH3•H2O+CO2=NH4HCO3;
②碳酸氢钠的溶解度很小,表现为沉淀,所以可以发生复分解反应,碳酸氢铵和氯化钠反应生成碳酸氢钠和氯化铵,故答案为:NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
③碳酸氢钠在受热的条件下生成碳酸钠、水和二氧化碳,故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(2)根据信息“在浓氨水中通入足量的二氧化碳生成一种盐,然后在此盐溶液中加入细的食盐粉末”判断,原始原料有氨水、二氧化碳、氯化钠,化学式分别为:NH3•H2O;CO2;NaCl.
根据信息“由于大部分酸式碳酸盐不稳定,加热后容易转化为正盐、水和二氧化碳,所以将析出的碳酸氢钠加热分解即可制得纯碱”可知,最终产物是纯碱,另外,在得到碳酸氢钠的现时还得到一种副产物氯化铵,化学式分别为:Na2CO3、NH4Cl.
在生产过程发生的反应有CO2+NH3.H2O═NH4HCO3、NaCl+NH4HCO3=NaHCO3↓+NH4Cl和2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑它们分别为化合反应、复分解反应、分解反应,缺少置换反应类型;
故填:NH3•H2O;CO2;NaCl;Na2CO3、NH4Cl;置换反应
(3)A、生产过程步骤④得到的氯化钠溶液可作为步骤②制碳酸氢钠的原料循环使用,所以正确.
B、副产品是氯化铵,其中含有氮元素,是一种氮肥,所以正确.
C、步骤③碳酸氢钠分解制纯碱时需要加热,所以错误.
D、氯化铵是一种氮肥,可再利用,不是污染物,所以正确.
故选:ABD.
(4)氨气极易溶于水,如果打开止水夹,氨气溶于水后烧瓶内压强迅速减小,而形成喷泉;加热时烧瓶内压强增大,气体体积膨胀,当氨气与水接触时,因氨气极易溶于水而导致烧瓶内压强迅速减小而形成喷泉,
故答案为:打开止水夹,挤出胶头滴管中的水;打开夹子,用手(或热毛巾等)将烧瓶捂热,氨气受热气体膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉.
(5)氯化钙可以和碳酸氢钠反应生成白色沉淀碳酸钙、氯化钠、水和二氧化碳,故填:CaCl2+2NaHCO3=CaCO3↓+2NaCl+CO2↑+H2O
点评 本题考查氨气的制备和性质,题目难度不大,本题注意形成喷泉的原理和操作方法.书写化学方程式时,首先分析应用的原理,然后根据反应物、生成物书写方程式,注意要遵守书写规则.


科目:初中化学 来源: 题型:解答题
 甲、乙是初中化学常见的物质,它们在一定条件下能如图所示相互转化.
甲、乙是初中化学常见的物质,它们在一定条件下能如图所示相互转化.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①②④ | C. | ②④⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 连二亚硫酸钠与水能剧烈反应,化学性质很活泼 | |
| B. | 连二亚硫酸钠是一种盐,硫元素化合价为+6价 | |
| C. | 连二亚硫酸钠俗称“保险粉”,原因是化学性质很稳定 | |
| D. | 连二亚硫酸钠俗称“保险粉”,无须密封保存 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com