
分析 氢氧化钠与氯化镁溶液反应生成氢氧化镁沉淀和氯化钠,由质量守恒定律,计算出生成沉淀的质量;由生成沉淀的质量,由反应的化学方程式列式计算出参加反应的氢氧化钠的质量、生成氯化钠的质量,进而计算出原混合物中氢氧化钠的质量分数即可.
解答 解:(1)由质量守恒定律,生成氢氧化镁沉淀的质量为105.8g+22.8g-117g=11.6g.
(2)参加反应的氢氧化钠的质量为x,生成氯化钠的质量为y
2NaOH+MgCl2═Mg(OH)2↓+2NaCl
80 58 117
x 11.6g y
$\frac{80}{58}=\frac{x}{11.6g}$ x=16g.
$\frac{58}{117}=\frac{11.6g}{y}$ y=23.4g
117g质量分数为30%的氯化钠溶液中含氯化钠的质量为117g×30%=35.1g.
原混合物中氯化钠的质量为35.1g-23.4g=11.7g.
原混合物中氢氧化钠的质量分数为$\frac{16g}{16g+11.7g}$×100%≈57.8%.
答:(1)生成沉淀的质量为11.6g;
(2)原混合物中氢氧化钠的质量分数为57.8%.
点评 本题难度不大,掌握根据化学方程式的计算即可正确解答本题,根据质量守恒定律计算出氢氧化镁沉淀的质量是正确解答本题的前提和关键.


科目:初中化学 来源: 题型:选择题
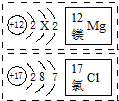
| A. | 镁原子结构图中X=8 | B. | 氯元素的原子序数为17 | ||
| C. | 镁是金属元素、氯是非金属元素 | D. | 镁原子易失去电子带负电荷 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
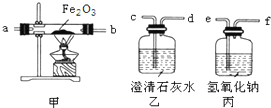 4月17日,重庆市渝中区石板坡的一幢民房发生火灾后,某中学化学兴趣小组想探究火灾现场附近的空气中是否含有CO气体.设计实验方案如下:
4月17日,重庆市渝中区石板坡的一幢民房发生火灾后,某中学化学兴趣小组想探究火灾现场附近的空气中是否含有CO气体.设计实验方案如下:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
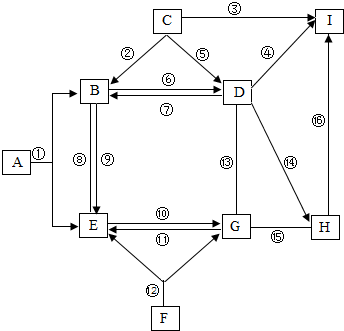 A~J都是初中化学中的常见物质,它们之间的关系如图所示(图中省略了反应条件,部分反应物或部分生成物),图中”→“表示箭尾的物质可转化成箭头的物质;”-“表示两端的物质能发生化学反应,”
A~J都是初中化学中的常见物质,它们之间的关系如图所示(图中省略了反应条件,部分反应物或部分生成物),图中”→“表示箭尾的物质可转化成箭头的物质;”-“表示两端的物质能发生化学反应,” “表示两端的物质能发生化学反应,又表示箭尾的物质可转化成箭头的物质;”?“表示两端物质间可互相转化,A是天然气的主要成分,I、H是两种常见的金属(其中金属I的颜色为红色).③和⑦的反应物质均为置换反应(形如AB+C→CB+A).请回答下列内容
“表示两端的物质能发生化学反应,又表示箭尾的物质可转化成箭头的物质;”?“表示两端物质间可互相转化,A是天然气的主要成分,I、H是两种常见的金属(其中金属I的颜色为红色).③和⑦的反应物质均为置换反应(形如AB+C→CB+A).请回答下列内容查看答案和解析>>
科目:初中化学 来源: 题型:解答题
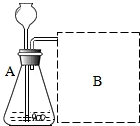 研究性学习小组选择“H2O2生成O2的快慢与什么因素有关”的课题进行探究.
研究性学习小组选择“H2O2生成O2的快慢与什么因素有关”的课题进行探究.| 实验编号 | 1 | 2 |
| 反应物 | 6%H2O2 | 6%H2O2 |
| 催化剂 | 1g红砖粉 | 1gMnO2 |
| 时间 | 152秒 | 35秒 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 含有氧元素的化合物称为氧化物 | |
| B. | 同种元素组成的物质一定是纯净物 | |
| C. | 质子数相同的粒子一定是同种元素 | |
| D. | 多种元素形成的纯净物一定是化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com