
【题目】用浓硫酸配制100g9.8%的稀硫酸。
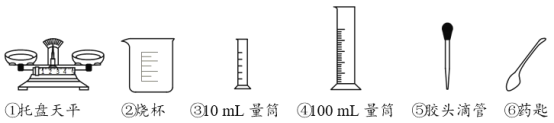
(1)实验需要5.4mL浓硫酸和90mL水。量取两种液体用到的仪器有___(填序号,下同)。
(2)下列稀释操作步骤正确的是___。
A 先将5.4mL浓硫酸倒入烧杯中,再将90mL水倒入浓硫酸中
B 先将90mL水倒入烧杯中,再将5.4mL浓硫酸缓慢倒入水中,并不断进行搅拌
C 同时将5.4mL浓硫酸和90mL水倒入同一烧杯中
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:初中化学 来源: 题型:
【题目】向一定质量的AgNO3和Fe(NO3)2的混合溶液中加入a克Zn粉,充分反应后过滤,将洗涤、干燥后称量,得到的固体质量为a克。据此,下列说法正确的是( )
A. 滤液中的物质一定至少有两种
B. 取反应后的滤液滴加稀盐酸,可能有白色沉淀产生
C. 取滤渣滴加稀盐酸,一定有气泡产生
D. 取反应后的滤液观察,滤液一定呈无色
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组通过探究活动学习和理解化学知识.请你一起研究学习,并回答有关问题.
研究主题:水溶液中复分解反应的实质
相关信息:一定体积的溶液中,离子的数目越多,其离子的浓度越大.电导率传感器用于测量溶液的导电性强弱,能反映离子浓度大小.相同温度下同种溶液电导率越大,离子浓度越大.
(1)实验一:恒温条件下,向100mL一定浓度的稀Ba(OH)2溶液中滴加2﹣3滴无色酚酞试液,插入电导率传感器,然后滴加稀硫酸,测得溶液的电导率变化如图中甲曲线所示.
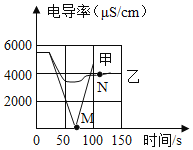
①甲曲线M点时混合液体呈_____色;
②通过对甲曲线的分析,下列说法错误的是_____(填序号).
a.M点前曲线下滑的过程中,H+和OH﹣结合成H2O,Ba2+和SO42﹣结合成BaSO4
b.M点时离子浓度几乎为零
c.M点后溶液电导率逐渐增大,仅由于溶液中H+在逐渐增大
③经测定,M点时消耗稀H2SO4溶液50mL,且过滤后滤液质量为147. 67g。请计算原Ba(OH)2溶液的溶质质量分数_____ (写出计算过程,各种稀溶液的密度都可看成1g·mL-1)。
(2)实验二:恒温条件下,向100mL同浓度的稀Ba(OH)2溶液中滴加2﹣3滴无色酚酞试液,插入电导率传感器,然后滴加稀Na2SO4溶液,测得溶液的电导率变化如上图乙曲线所示.
①通过对乙曲线的分析,下列说法错误的是_____(填序号).
a.开始至完全反应过程中,电导率减小,溶液由红色逐渐变为无色
b.电导率下降到最低点时仍然较大,表明溶液中还存在较多离子
c.整个实验过程中,溶液中Na+数目一直增大
②N点时,溶液中含有的离子是______________(填离子符号).
③通过比较分析,结合已学知识可知,溶液中复分解反应的实质是参与反应的离子,结合生成了沉淀、气体或水,导致其浓度_____(填“增大”或“减小”).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学实验中经常用到一定溶质质量分数的溶液,请回答:
(1)小明在实验室配置质量分数为12%的碳酸钠溶液。
①计算:配制100g该碳酸钠溶液需要碳酸钠固体的质量为_________g。
②称量:用托盘天平称量所需的碳酸钠,放入烧杯中,小明在称取时发现托盘天平的指针偏向右盘,正确的做法是_________(填序号)。
a 增加砝码 b减少砝码 c添加固体 d减少固体 e调节平衡螺母向右旋
③量取:用量筒量取水(水的密度是1g/mL)的体积时仰视读取液体体积,读数比实际量取液体体积________________(填偏大、偏小或不变)
④溶解:用玻璃棒搅拌,使碳酸钠溶解。
⑤将配制好的溶液装入试剂瓶,盖好瓶塞,贴上标签,请帮小明完成如图标签内容。_______

(2)小刚要把(1)配得的溶液稀释为6%,需要加水的质量为___________g。
(3)稀硫酸常作为工业上的除锈剂,现配制4.9%的稀硫酸2000g,需要98%的浓硫酸(密度为1.84g/mL)___________mL(计算结果精确至0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某兴趣小组发现铁钉生锈需要几天的时间,询问老师如何加快铁钉生锈的速度。
老师说氯化物可能加快铁钉生锈的速度。
【提出问题】氯化物对铁钉生锈有怎样的影响?
【查阅资料】
ⅰ.NaCl、CaCl2、CuCl2等由氯离子与金属离子构成的盐属于氯化物。
ⅱ.铜能与氧气反应,生成黑色的CuO。
ⅲ.CuO能与稀硫酸发生反应:CuO + H2SO4 ==== CuSO4 + H2O。
【进行实验、分析解释、获得结论】
实验1:探究氯化物对铁钉生锈速度的影响。
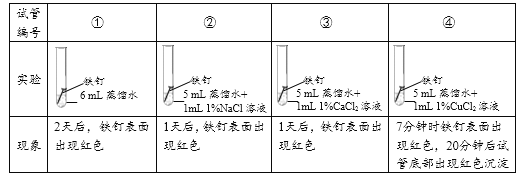
(1)对比实验①②③可以得到的结论是_________。
(2)小组同学认为,试管④中的红色沉淀可能是铁锈,也可能是铜。他们认为红色沉淀可能是铜的理由是__________(用化学方程式解释)。
实验2:探究试管④中红色沉淀的物质组成。
实验步骤 | 实验操作 | 实验现象 |
Ⅰ | 取出试管④中的铁钉,过滤剩余物,洗涤滤纸上的物质 | 固体为红色 |
Ⅱ | 将步骤Ⅰ所得红色固体加入试管中,再向试管中加入足量的___________ | 红色固体大部分溶解,溶液变为黄色 |
Ⅲ | 将步骤Ⅱ所得混合物过滤,洗涤、干燥滤纸上的固体后,置于石棉网上充分加热 | 红色固体变黑 |
Ⅳ | 向试管中加入步骤Ⅲ所得黑色固体,再加入足量稀硫酸 | 黑色固体全部溶解,溶液变为蓝色 |
(3)步骤Ⅱ中所加入的试剂是_________。
(4)步骤Ⅲ、Ⅳ的实验目的是_________。
(5)由实验2可得出结论:试管④中红色沉淀的物质组成是_________。
【反思与评价】
(6)结合实验1、2的结论,对于“氯化物对铁钉生锈速度的影响”,小组同学提出了进一步的假设:__。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙三种物质的转化关系如右图所示(“→”表示反应一步实现,部分物质和反应条件已略去)。下列选项不能实现图示转化的是
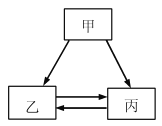
选项 | 甲 | 乙 | 丙 |
A | H2SO4 | H2 | H2O |
B | C | CO | CO2 |
C | Ca(OH)2 | CaCl2 | CaCO3 |
D | NaOH | NaCl | NaNO3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】兴趣小组的利用提供的试剂:稀硫酸、澄清石灰水、氯化钠溶液、硫酸铜溶液和紫色石蕊溶液。探究酸碱盐的性质。小清同学将氯化钠溶液加入到稀硫酸中没有观察到明显现象,而将混合溶液加热一段时间后,意外地闻到刺激性气味。
[提出问题]刺激性气味的气体是什么?
[猜想与假设]猜想1.可能是二氧化硫 猜想2.可能是氯化氢
猜想3.可能是氨气
大家讨论后认为猜想3不合理,依据是_____________________。
[查阅资料] SO2和CO2的化学性质相似,都能使澄清灰水变浑浊。写出二氧化硫和氢氧化钙的反应的化学方程式:____________________________。
[实验探究]如图所示,小诚将产生的气体通入紫色石蕊溶液中,观察到_________,于是他认为猜想2正确。
[评价与改进]小煜认为小诚的结论不科学,于是他利用提供的试剂通过实验确认了猜想2正确。
实验操作 | 实验现象 |
如图所示,将产生的气体________________ | _____________________ |
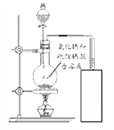
[结论]加热氯化钠与硫酸的混合溶液得到的气体是氯化氢
[拓展应用]实验室可用氯化钠和硫酸反应制取氯化氢气体,已知氯化氢气体极易溶于水。请推测实验室制取氯化氢气体最适宜的方法为________________(填序号)。
A.加热氯化钠溶液和稀硫酸的混合物 B.加热氯化钠固体和稀硫酸的混合物
C.加热氯化钠固体和浓硫酸的混合物
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A﹣G是初中化学中常见的物质,其相互反应及转化关系如图所示,部分反应条件省略.已知A是易与人体血红蛋白结合的有毒气体,B是赤铁矿的主要成分,C是相对分子质量最小的氧化物,F是最轻的气体.
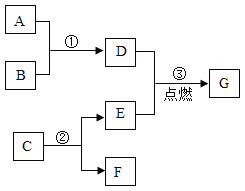
(1)G的化学式为____________。
(2)写出相应反应的化学方程式:
①____________。②____________。
(3)反应③的实验现象是____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】NaCl在生产和生活中具有广泛的用途,是一种重要的资源。通过晾晒海水可以得到粗盐和母液(又叫苦卤)。下图为母液中最主要的四种盐(NaCl、KCl、MgCl2、MgSO4)的溶解度曲线图。回答下列问题:

(1)①90℃时,四种盐中MgCl2的溶解度最大,则表示MgCl2溶解度曲线的是_________。(填“A”或“B”)此时饱和MgCl2溶液的质量分数为_______
(请写出计算表达式即可)
②四种盐中溶解度受温度变化的影响最小的是_____________。(填化学式)
(2)60℃时,若母液中的NaCl、KCl、MgCl2、MgSO4都已达到饱和,为了获得较纯净的MgSO4晶体,可采用的最好方法是_______________。
(3)工业上常通过加入碱溶液与母液中的Mg2+反应来制取Mg(OH)2沉淀。为了探究获得较高Mg2+沉淀率的反应条件,进行下列对比实验(每组实验取250mL母液)
实验序号 | 反应温度/℃ | 反应时间/min | 反应pH值 | Mg2+的沉淀率/% |
a | 40 | 60 | 10 | 90.1 |
b | 40 | 60 | 12 | 92.7 |
c | 40 | 90 | 12 | 93.6 |
d | 50 | 60 | 12 | 96.4 |
e | 50 | 90 | 12 | X |
①本实验研究了哪些因素对Mg2+的沉淀率的影响_______
②实验a和b对比,可得到的结论是_______
③表格中x的数值可能为__________(填字母)。
A 95.8 B 92.1 C 97.2 D 93.1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com