
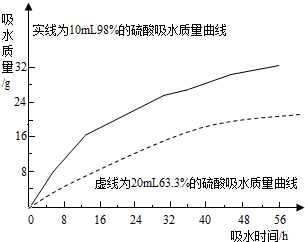
 硫酸是常见的酸,也是常用的化工原料.由于浓度不同,浓硫酸与稀硫酸在性质上存在较大差异,如浓硫酸具有脱水性、吸水性和强腐蚀性等.某课外兴趣小组为了探究浓硫酸的某些特性做了如下一些实验.请结合有关实验,按要求回答下列问题:
硫酸是常见的酸,也是常用的化工原料.由于浓度不同,浓硫酸与稀硫酸在性质上存在较大差异,如浓硫酸具有脱水性、吸水性和强腐蚀性等.某课外兴趣小组为了探究浓硫酸的某些特性做了如下一些实验.请结合有关实验,按要求回答下列问题:| 方案 | 实验假设 | 实验方案 | 实验现象与结论 |
| Ⅰ | 能发生钝化 | 取一铁片先插入浓硫酸中,一段时间后取出,再插入硫酸铜溶液中. | 无明显变化,假设成立. |
| Ⅱ | 能发生钝化 | 取两片相同的铁片,一片放入浓硫酸中,一段时间后取出,与另一片同时放入硫酸铜溶液中. | 浸过浓硫酸的铁片表面无明显变化,另一铁片表面产生红色固体,假设成立. |
分析 (1)依据浓硫酸具有的脱水性与吸水性进行分析判断;
(2)①根据浓硫酸的稀释过程的操作要领分析解答;
②从曲线观察两种不同的酸的吸水情况的变化趋势分析解答;
(3)①根据对比实验的特点从浸过浓硫酸的铜片不会发生反应,而未浸过浓硫酸的铁片发生了反应的情况描述现象和结论即可;
②根据对比实验的设计要求,利用不同处理的铁片与稀硫酸反应进行对比实验进行设计即可;
③根据加热前后反应的温度变化及发生情况进行分析说明即可.
解答 解:(1)浓硫酸具有的脱水性与吸水性,用玻璃棒蘸取少量浓硫酸在滤纸上写字,过后观察,字迹显黑色是因为其脱水性导致的纸张炭化,而除去氢气或氧气中的水分,是利用其吸水性,起到干燥剂的作用;
(2)①因为浓硫酸溶解会放出大量的热,密度比空气大,为防止酸溅出,因此浓硫酸的稀释时应酸入水并不断搅拌使溶解时产生的热量尽快散失;
②从曲线观察两种不同的酸的吸水情况的变化可知:浓硫酸和一定浓度以上的稀硫酸都具有吸水性;浓硫酸吸水能力比稀硫酸强(吸水速度快、吸水量大);开始两者吸水速度差异比较大,随着时间的推移吸水速度越来越接近,吸水能力越来越弱;硫酸浓度越稀吸水性越弱,到一定浓度后就失去吸水性;硫酸吸水能力可能会受环境温度、湿度、气压、酸的用量、表面积等因素的影响等.
(3)①根据对比实验的特点从浸过浓硫酸的铜片不会发生反应,而未浸过浓硫酸的铁片发生了反应,所以未浸过浓硫酸的铁片能置换出硫酸铜中的铜,而浸过浓硫酸的铁片由于发生了钝化则不会与硫酸铜发生反应,II的设计采用了对比实验的方法进行探讨,体现了对比实验的科学性,强调了结论的正确性.
②根据对比实验的设计要求,可对浸过浓硫酸的铁片和未浸过浓硫酸的铁片与稀硫酸进行接触,看反应的发生情况从而判断是否发生了钝化现象;
③由实验叙述可知,两种情况的差别实质就是反应时温度的变化,所以可从该处做出发点分析温度对反应的影响,可以是加热条件下,氧化膜被破坏(被浓硫酸溶解),铁继续与浓硫酸反应.(或热的浓硫酸能与铁反应产生刺激性气体;或热的浓硫酸不能使铁钝化;或铁的钝化随条件的改变而改变;或铁与浓硫酸的作用与温度有关)(其它合理答案均可)等;根据信息铁和浓硫酸反应产生硫酸铁、水和二氧化硫,反应的方程式为:2Fe+6H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$Fe2(SO4)3+6H2O+3SO2↑;
故答案为:(1)脱水; 吸水;
(2)①浓硫酸,水; ②浓硫酸和一定浓度以上的稀硫酸都具有吸水性;浓硫酸吸水能力比稀硫酸强(吸水速度快、吸水量大);开始两者吸水速度差异比较大,随着时间的推移吸水速度越来越接近,吸水能力越来越弱;硫酸浓度越稀吸水性越弱,到一定浓度后就失去吸水性;硫酸吸水能力可能会受环境温度、湿度、气压、酸的用量、表面积等因素的影响等.
(3)①
| 实验现象与结论 |
| 浸过浓硫酸的铁片表面无明显变化,另一铁片表面产生红色固体. |
点评 该题属于实验方案的探究题,主要是采用对比实验的方法对实验中的问题进行探讨,掌握设计实验的目的及方法是解题的关键所在.


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:初中化学 来源: 题型:选择题

| A. | 加碘食盐中的“碘”是碘单质 | |
| B. | 碘酸钾中K、I、O三元素的化合价分别为1+、5+、2- | |
| C. | 碘酸钾的相对分子质量为182 | |
| D. | 氯化钠中钠元素的质量分数约为39.3% |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 反应前后化学性质不发生改变 | B. | 反应前后质量发生了改变 | ||
| C. | 能改变某些化学反应的速率 | D. | 某些催化剂可催化不同的反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 空气中含量最多的元素是氮元素 | |
| B. | 氮气化学性质不活泼,可用于食品防腐 | |
| C. | 空气中的氧气主要来自植物的光合作用 | |
| D. | 空气中的氧气支持燃烧,所以氧气是一种常见的燃料 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 稀有气体原子的最外层电子数(He除外)是8,故最外层电子数为8的粒子一定是稀有气体原子 | |
| B. | 氧化物中含有氧元素,故含有氧元素的化合物一定是氧化物 | |
| C. | 置换反应有单质参加和生成,故置换反应中有元素化合价的改变. | |
| D. | 测定溶液的pH时,若用水将pH试纸湿润,测定结果一定不准确 |
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | NaOH溶液 | B. | 水 | C. | K2SO4溶液 | D. | Na2CO3溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com