
【题目】化学是一门以实验为基础的科学,请结合图示回答问题:
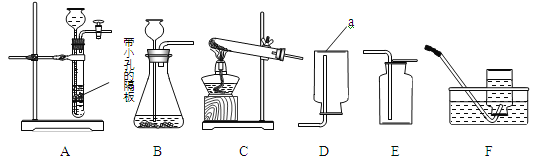
①写出仪器a的名称 (6) 。
②实验室用大理石和稀盐酸制取二氧化碳,发生反应的化学方程式为 (7) ;
通常不用碳酸钙粉末与稀盐酸反应制取CO2的原因是 (8) ;若要制取并收集一瓶CO2,且能使反应随关随停,选用的装置组合是 (9) (填字母);证明二氧化碳已收集满的方法是 (10) 。
③实验室用双氧水和二氧化锰粉末制取氧气时;在二氧化锰的催化作用下,过氧化氢迅速分解生成氧气和水,反应的化学方程式为 (11) 。哪些因素还影响着过氧化氢分解的速率?甲小组探究了溶质质量分数对过氧化氢分解的速率有影响,乙小组进行了更深入的探究:温度是否影响着过氧化氢分解的速率呢?
实 验 步 骤 | 现 象 | 结 论 |
取一支试管,加入5mL5%的过氧化氢溶液,然后把试管放入盛有冷水的烧杯中; | 缓慢有少量 气泡冒出 | (13) |
另取一支试管,加入 (12) , 然后把试管放入盛有热水的烧杯中。 | 迅速有大量 气泡冒出 |
④丙小组用装置C制取氧气,试管中固体的质量随加热时间变化的数据见下表。反应结束后,将剩余固体用适量水充分溶解后,过滤,回收二氧化锰固体,并得到氯化钾溶液100g。
加热时间/min | 0 | t1 | t2 | t3 |
固体质量/g | 28.0 | 23.2 | 18.4 | 18.4 |
(I)组装装置C时,下列仪器、用品的组装顺序是 (14) (填序号)。
a.试管 b.铁架台 c.酒精灯 d.木块
(II)共制得氧气的物质的量为 (15) mol。
(III)所得氯化钾溶液的溶质质量分数(根据化学方程式列式计算) (16) 。
【答案】(6)集气瓶 (7)CaCO3+2HCl===CaCl2+H2O+CO2↑ (8)反应快,不易控制
(9)A E (10)将燃着的木条放在集气瓶瓶口,火焰熄灭,则已收集满
(11)2H2O2![]() 2H2O+O2 ↑ (12)5mL5%的过氧化氢溶液
2H2O+O2 ↑ (12)5mL5%的过氧化氢溶液
(13)温度越高,过氧化氢分解的速率越快(或温度对过氧化氢分解的速率有影响)
(14)b d c a (15)0.3
【解析】
![]() 试题分析:(2)实验室用大理石和稀盐酸制取二氧化碳,生成的是氯化钙、水和二氧化碳:CaCO3+2HCl===CaCl2+H2O+CO2↑;由于碳酸钙粉末与稀盐酸反应的速率过快,不便于收集二氧化碳气体,故实验室不用它们来制取二氧化碳气体;实验室制取二氧化碳属固液在常温下的反应,由于B装置不能控制反应的发生和停止,故选A装置。A装置中将石灰石放在隔板上,然后往长颈漏斗中加稀盐酸,当需要反应停止时,关闭弹簧夹,稀盐酸进入长颈漏斗中,固体和液体分离,反应停止;二氧化碳的密度比空气大,易溶于水,只能用向上排空气法收集,验满的方法是将燃着的木条放在集气瓶瓶口,火焰熄灭,则已收集满;
试题分析:(2)实验室用大理石和稀盐酸制取二氧化碳,生成的是氯化钙、水和二氧化碳:CaCO3+2HCl===CaCl2+H2O+CO2↑;由于碳酸钙粉末与稀盐酸反应的速率过快,不便于收集二氧化碳气体,故实验室不用它们来制取二氧化碳气体;实验室制取二氧化碳属固液在常温下的反应,由于B装置不能控制反应的发生和停止,故选A装置。A装置中将石灰石放在隔板上,然后往长颈漏斗中加稀盐酸,当需要反应停止时,关闭弹簧夹,稀盐酸进入长颈漏斗中,固体和液体分离,反应停止;二氧化碳的密度比空气大,易溶于水,只能用向上排空气法收集,验满的方法是将燃着的木条放在集气瓶瓶口,火焰熄灭,则已收集满;
(3)过氧化氢分解生成的是水和氧气:2H2O2 ====== 2H2O+O2 ↑;探究温度对过氧化氢分解速率的影响应采用控制变量法,即温度不同,其他的条件要完全相同;通过反应的现象可知温度越高,过氧化氢的分解速率越快;
(4)装置C属固固加热型,组装的顺序是铁架台→木块→酒精灯→试管;
依据质量守恒定律化学反应前后物质的总质量不变,那么减少的质量即为生成的氧气的质量,
氧气的质量=28g-18.4g=9.6g
解:设反应生成氯化钾的物质的量为x,
2KClO3![]() 2KCl + 3O2↑
2KCl + 3O2↑
149 96
x 9.6g
149:x = 96:9.6g
x =14.9g
所得氯化钾溶液溶质质量分数为:14.9/100×100% == 14.9%
答:所得氯化钾溶液的溶质质量分数为14.9%。


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】(8分)水是生命之源,人类的日常生活离不开水。
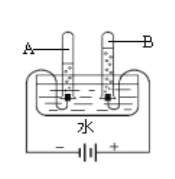
(1)小红利用下图所示的装置探究水的组成。通电一段时间后,试管B中所收集的气体为 ,该实验说明水是由________________组成的。
(2)自制净水器中常加入____________(填名称),用于除去水中的异味和色素。
(3)云南水资源丰富,但分布不均,有些村民用地下水作为生活用水,人们常用____________区分硬水和软水;生活中可用____________的方法降低水的硬度。
(4)电解水的方程式为__________________________________;
(5)请举一例生活中节约用水的集体措施________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列说法中正确的是
A.随着社会的发展,人类需水量会增加
B.水资源很丰富,无需节约用水
C.水有自净作用,因此不会被污染
D.只要水是无色、透明的,就一定未被污染
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(8分)有某固体混合物,已知该混合物中可能含有FeCl3、NaCl、NH4NO3、CuSO4四种物质中的两种或多种。为探究其组成,做了如下实验(设过程中所有发生的反应都恰好完全反应)。试根据实验过程和发生的现象填写以下空白:

(1)用湿润的红色石蕊试纸测试气体A,试纸变__________色;C的化学式为: 。
(2)固体混合物里.上述四种物质中,肯定不存在的物质是______________(写化学式)。
(3)在溶液D中,一定含有的阴离子是(写离子符号)_____________。
(4)步骤②中发生反应的化学方程式为______________________________________。
(5)固体混合物里,上述四种物质中,还不能确定存在的物质是(写化学式)________,
要进一步确定该固体混合物成分,可用溶液D再实验,请简要说明实验操作步骤、发生的现象及结论 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知A是固体碱式碳酸铜,其化学式是Cu2(OH)2CO3,它受热可分解为三种化合物,物质转化关系如图所示。其中C、F、H、I是无色气体,B通电时,在阴极产生I,在阳极产生H。根据推断回答下列问题:
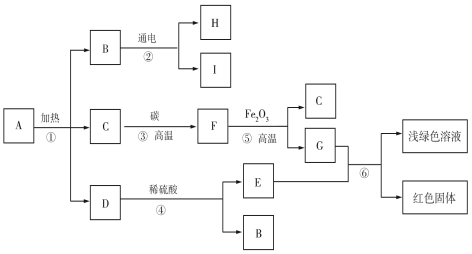
(1)铜锈的主要成分是碱式碳酸铜。铜生锈与空气中氧气和水有关,还与空气中的____________(填化学式)有关。
(2)E物质的化学式是 。
(3)在①~⑥反应中属于化合反应的是 (填数字序号)。
(4)反应⑤的化学方程式 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室制二氧化碳有以下步骤:①向锥形瓶内加入大理石 ②检查装置气密性 ③向分液漏斗中加入稀盐酸 ④按要求连接好仪器和装置 ⑤将燃着的木条放在瓶口检验 ⑥用向上排空气法收集。正确的顺序是( )
A.③②①④⑥⑤ B.④②①③⑥⑤
C.①③②④⑥⑤ D.④③②①⑤⑥
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某小组对测定空气中氧气体积分数的实验进行了如下研究
① 选用汞、磷、铜等物质均可以完成该实验,选择反应物的依据是 (8) 。
A、反应物是固体 B、在空气中反应且只消耗氧气
C、燃烧有明显现象 D、生成物不是气体
② 用甲、乙两套装置进行实验(红磷充足、装置不漏气)。红磷燃烧的化学方程式是 (9) ,有关分析合理的是 (10) 。
A、都只能在实验结束后,推得氮气是无色气体
B、甲中燃烧匙伸入集气瓶太慢,测得空气中氧气的体积分数将偏大
C、乙中的瘪气球可以防止燃烧放热使橡胶塞弹出
D、乙比甲更节约能源

③ 利用乙装置实验时,先关闭弹簧夹,加热使红磷反应,待装置冷却至室温后打开弹簧夹。反应前后各数据及结论如下。
玻璃管中原有 空气的体积 | 注射器中气体的体积 | 结论 | ||
反应前 | 反应后 | |||
(11) ml | 40 ml | 30 ml | 氧气约占空气体积的五分之一 | |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】同学们已经学习了氧气和二氧化碳的实验室制法,请你参与总结与分析:

【仪器认识】装置A中仪器的名称:a (1) ,b (2) ;装置C的名称: (3)
【反应原理】用双氧水和二氧化锰混合制取氧气的化学方程式为 (4) ;
用大理石和稀盐酸制取二氧化碳的化学方程式为 (5) 。
【制取装置】用氯酸钾与二氧化锰制取氧气,可选用的发生装置是 (6) ,若收集较纯净的氧气最好选用 (7) 装置,收满的现象是 (8) 。
实验室制取二氧化碳气体,可选用的装置组合是 (9) 或 (10) ,
检验二氧化碳是否收满的方法是 (11) (简述实验操作、现象、结论)。
比较B、C装置,C装置在制取气体时,明显的优点是 (12) 。
【数据分析】实验小组用氯酸钾和二氧化锰的混合物制取氧气,反应过程中混合物的质量变化如图所示。完全反应后最终收集到0.3 mol氧气。

①请根据化学方程式列式计算原混合物中含氯酸钾的质量。(13)
②图中P点处试管内的固体物质有 (14)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学与生活息息相关。
现有氦气、氧气、甲烷、二氧化碳、二氧化硫、食盐,请用化学式按要求填空:
①供人呼吸的气体是 (1) ;
②促进光合作用的气体是 (2) ;
③会引起酸雨的气体是 (3) ;
④天然气的主要成分是 (4) ;
⑤医疗上常用0.9%生理盐水给病人补充体液。生理盐水中溶质是 (5) ;
⑥充入霓虹灯内且通电时会发出有色光的气体是 (6) 。
⑦如下图下列物质的用途中,利用了石墨导电性的是 (7) (填编号,下同);利用了金刚石硬度大的是 (8) ;利用了石墨质软,划过留下痕迹的是 (9) 。

a.玻璃刀 b.铅笔芯 c.干电池的电极
⑧二氧化碳是可以利用的重要资源。如在一定条件下可以制造金刚石:
![]() ,反应中属于非金属单质的是 (10) ,由游离态变为化合态的是 (11) 元素。
,反应中属于非金属单质的是 (10) ,由游离态变为化合态的是 (11) 元素。
⑨乙醇俗称酒精(化学式:C2H5OH)是一种重要的工业原料。乙醇由 (12) 种元素组成,碳、氢元素的物质的量之比为 (13) ;乙醇的摩尔质量是 (14) ,碳元素的质量分数为 (15) ;3.01×1024个乙醇分子的物质的量是 (16) mol,9.2g乙醇中含 (17) 个乙醇分子;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com