
【题目】化学小组同学在课外读物中看到:“加热时,过氧化钠(Na2O2)能与木炭发生化学反应”。他们决定探究Na2O2与木炭反应的产物。
(猜想与假设)木炭与Na2O2反应可能生成4种物质:CO、CO2、Na2O和Na2CO3。
(查阅资料)
① 碱性的碳酸钠溶液与中性的CaCl2溶液能发生复分解反应。
② 氧化钠(Na2O)是白色固体,与H2O反应生成NaOH。
③ 氯化钯(PdCl2)溶液能检验CO的存在,向溶液中通入CO,产生黑色沉淀。
(进行实验)同学们在老师的指导下设计了如下图所示装置(部分夹持仪器已略去)。
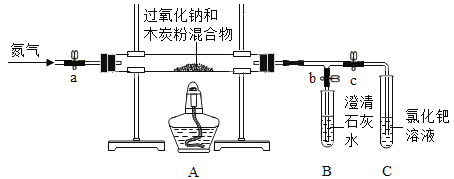
序号 | 实验操作 | 主要实验现象 | 实验结论 |
① | 检查装置气密性。向玻璃管中加入过氧化钠和过量木炭粉的混合物。打开弹簧夹a、b,关闭c,从装置左端通一段时间N2。 | A中无明显变化,B中有大量气泡冒出。 | 气密性良好。 |
② | 关闭a,点燃酒精灯。 | 试管中发生剧烈反应,产生火花,________________。 | 产物中没有CO2。 |
③ | 打开c,关闭b。 | C中PdCl2溶液没有明显变化。 | ___________________。 |
④ | 打开a,继续通N2,停止加热,待冷却后停止通N2。取出少量反应后固体于试管中,加入足量稀盐酸,迅速用带导管的橡胶塞塞紧试管口,导管另一端通入石灰水中。 | _____________________。 | 产物中有Na2CO3。 |
(解释与结论)
(1)检验第4种物质存在的实验方案:取出少量反应后固体于试管中,_______________,则第4种物质存在。
(2)Na2O2与木炭反应的化学方程式为_________________________________。
(反思与评价)实验操作④中若不通入N2,可能造成的结果是________________________。
【答案】B中澄清石灰水无明显现象 产物中没有CO 试管内有气泡产生,底部有黑色固体,澄清石灰水变浑浊 加入足量水充分溶解,再加入足量的氯化钙溶液,过滤,向滤液中滴加几滴无色酚酞溶液,溶液变红 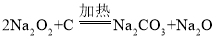 C中液体倒吸入A中,使玻璃管炸裂
C中液体倒吸入A中,使玻璃管炸裂
【解析】
[进行实验]②实验结论为没有二氧化碳,所以B中澄清石灰水不变浑浊,即可证明气体中没有二氧化碳;
故答案为:B中澄清石灰水无明显现象。
③通入氯化钯溶液后,无明显现象,证明没有一氧化碳;
故答案为:产物中没有CO。
④实验结论是含有碳酸钠,盐酸与碳酸钠反应生成了二氧化碳,二氧化碳为气体,可以产生气泡,通入澄清石灰水后澄清石灰水变浑浊,而加入的炭粉过量,不与盐酸反应,所以有黑色固体沉于试管底部,因此可以看到试管内有气泡产生,底部有黑色固体,澄清石灰水变浑浊的现象;
故答案为:试管内有气泡产生,底部有黑色固体,澄清石灰水变浑浊。
[解释与结论](1)验证氧化钠的存在,固体中若存在氧化钠和碳酸钠,固体溶解于水后,氧化钠与水反应生成了氢氧化钠,碳酸钠溶于水,此时加入过量的氯化钙溶液,碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,过滤后取滤液,此时溶液内溶质为氢氧化钠、氯化钠和氯化钙,而氯化钠和氯化钙溶于水,都显中性,所以加入酚酞溶液,观察溶液是否变红,从而推出是否含氢氧化钠,最终得出是否含有氧化钠;
故答案为:加入足量水充分溶解,再加入足量的氯化钙溶液,过滤,向滤液中滴加几滴无色酚酞溶液,溶液变红。
(2)根据上述实验过程,可以看出反应物为过氧化钠和碳,生成物为碳酸钠和氧化钠,反应条件为加热,所以化学方程式为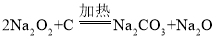 ;
;
故答案为: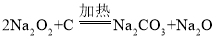 。
。
[反思与评价]若不通入氮气,停止加热后,内部温度降低,压强减小,外界大气压将液体从C中压入A中,引起倒吸,玻璃管炸裂;
故答案为:C中液体倒吸入A中,使玻璃管炸裂。


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】以下是老师引导学生探究“质量守恒定律”的教学片段,请你参与探究并帮忙填写空格(包括表中的空格)。
【提出问题】 化学反应前后各物质的质量总和是否相等?
【查阅资料】 氢氧化钠溶液可以吸收二氧化碳气体
【猜想与假设】 猜想1:不相等;猜想2:相等。
【实验探究】 甲、乙两组同学用托盘天平分别称量反应前后物质的质量。
甲组 | 乙组 | |
实验方案(反应后略) |
|
|
实验现象 | 有气泡产生,天平指针向右偏转 | _________,天平指针没有偏转 |
结论 | 猜想1正确,反应的化学方程 式:_______________. | 猜想2正确 |
【反思评价】 究竟哪种猜想正确?通过讨论,同学们发现甲组中有气体溢出,导致指针向右偏转。得到启示:在探究化学反应前后各物质的质量总和是否相等时,凡有气体生成或参加的反应一定要在_______________中进行。
【优化装置】 同学们对甲组左盘中的反应装置进行了如下三种改进,你认为最佳装置是(填序号)___,从另外两种装置中任选一种指出其不足:________。
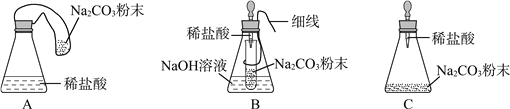
【得出结论】 同学们利用改进后的最佳装置进行再次探究,均得出猜想2正确。进一步
分析发现,反应体系中器材和未参加反应的物质的质量在反应前后保持不变,最终得出结论:_________________________的各物质的质量总和等于反应后生成的各物质的质量总和。
【解释应用】
解释:化学反应前后,原子的种类、数目、质量均不变,所以质量守恒。
应用:某固体物质受热会发生分解反应,生成氧化铜、水和二氧化碳三种物质,则该固体物质一定由_________种元素组成。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两种物质的溶解度曲线如图所示,请回答下列问题。
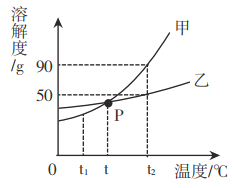
(1)t2℃时,乙物质溶解度是________________g。
(2)P点的意义是________________。
(3)t2℃时,将30g甲物质和乙物质分别加入到50g水中充分溶解,形成饱和溶液的是_____________(填“甲”或“乙”)。
(4)若甲物质中含有少量的乙物质,要提纯甲物质应进行________________(填“降温结晶”或“蒸发结晶”)。
(5)分别将甲、乙两种物质的等质量的饱和溶液从t2℃降温至t1℃,所得溶液的溶质质量分数:甲___乙(填“>”或“<”或“=”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国化工专家侯德榜发明了侯氏制碱法,为世界制碱工业作出了突出贡献。
(1)主产品Na2CO3的俗名是_____,副产品氯化铵中阳离子符号为_____。
(2)在实际生产中,产品Na2CO3中常混有少量的NaCl,现有样品11.0 g,将其放入干净的烧杯中,向烧杯中滴加入溶质质量分数为7.3%的稀盐酸,反应后烧杯中物质的质量与滴入稀盐酸的质量关系如图所示。
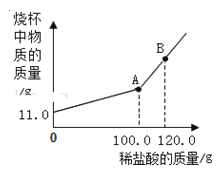
①图中A点表示_____,B点的溶质为_____。
②计算样品中Na2CO3的质量分数(计算结果精确至0.1%)_____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】以下是初中化学的一些基本实验,根据图示回答问题。
A 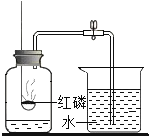 测定空气中O2含量
测定空气中O2含量
B 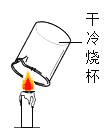 探究蜡烛的元素组成
探究蜡烛的元素组成
C 铁丝在空气中中的变化
铁丝在空气中中的变化
(1)A中集气瓶内水的作用是_____________________________________________。
(2)B中得出的实验结论是_____________________________。
(3)一段时间后,C中的实验现象为_______________,产生该现象的原因是______________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属和我们的关系很密切,它广泛地存在和应用于生产、生活等各个领域。
(1)下图为我们提供了金属铝、金属铁两种元素在元素周期表中的一些相关信息。
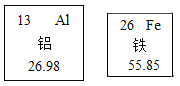
①铁原子核内的质子数为________________;
②铁元素相对原子质量为___________;
③铝的原子结构示意图为____________。
(2)乐乐兴趣小组在实验室进行实验探究:他们将两根完全相同的铝丝分别伸入到稀盐酸和稀硫酸中,观察发现铝丝产生气泡的快慢很是不同。
(提出问题)影响铝和酸反应速率的因素有哪些?
(大胆猜想)I.温度:
Ⅱ._______________:
Ⅲ.酸的种类。
(实验设计)为了验证猜想Ⅱ是否正确,乐乐兴趣小组的同学们进行了如下的实验探究。
实验步骤 | 实验观象 | 实验结论 |
打磨两根型号完全相同的铝丝,分别放入两支相同的试管中,再分别向其中倒入同体积、但不同浓度的稀盐酸 | ________________ | 酸的浓度越大,反应速率越快。 |
①上述反应的化学方程式为____________:
②使用铝丝前打磨的原因是___________。
③对铁质零件进行“发蓝”处理也是一种常用的防锈措施,因能在其表面形成致密氧化膜。若将该零件浸泡于硫酸铜溶液中,发现零件表面出现红色物质,便可以断定该铁质零件的“发蓝”处理效果不佳,原因是__________________。
(3)高铁的迅速发展对钢轨的需求量越来越大,质量要求越来越高。在工业上,经常用“铝热反应”原理来焊接钢轨,原理就是利用铝和氧化铁在高温条件下发生剧烈反应得到熔融的金属,其反应化学方程式为_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氯酸钾在工业上用于制造焰火、漂白剂等,在实验室可用于制造氧气。工业上利用石灰浆制备氯酸钾的流程是:

(1)写出实验室用氯酸钾制取氧气的化学方程式____________________。
(2)在实验室里,“操作a”中需要用到玻璃棒,其作用是__________。
(3)“反应1”的化学反应方程式为:6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6X,Ca(ClO3)2的名称是__________,X的化学式为__________。
(4)下表是有关物质常温下的溶解度。
物质 | KCl | CaCl2 | KClO3 | Ca(ClO3)2 |
溶解度/g | 34.2 | 74.5 | 7.3 | 209.0 |
“反应2”为复分解反应,参看表中溶解度,写出该反应的化学方程式__________。
(5)上述石灰浆可由电石(CaC2)与水反应制得。现有某电石渣,其中含氢氧化钙92.5%,用该电石渣处理含硫酸49Kg的酸性废水(假设电石渣中的杂质、废水中其他成分均不参加反应),需要电石渣的质量是__________kg。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列实验的操作、现象、结论均正确的是![]()
实验操作 | 现象 | 结论 | |
A | 向收集满CO2的软塑料瓶中加入约三分之一体积的NaCl溶液,旋紧瓶盖,振荡 | 塑料瓶变瘪 | CO2能与NaCl反应 |
B | 用玻璃棒取少量待测液滴在湿润的pH试纸上,与标准比色卡对照并读出待测液的pH | pH试纸显示pH=1对应的红色 | 待测液显酸性 |
C | 将白磷浸没在热水中,再向热水中的白磷通氧气 | 通氧气前白磷不燃烧,通氧气后白磷燃烧 | 氧气是燃烧需要的条件之一 |
D | 点燃从导管放出的某气体,在火焰上方罩一个冷而干燥的烧杯。 | 烧杯内壁有无色液滴产生 | 该气体一定是CH4 |
A.AB.BC.CD.D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某班学生在老师指导下探究铁与水蒸气的反应。
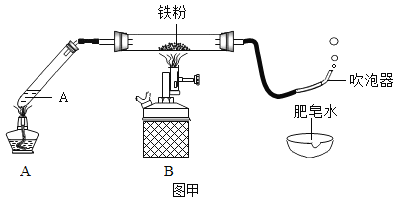
(1)按图甲装好药品、连好装置(夹持仪器已略去)。其中A装置的作用是______。
(2)加热一段时间后,灰色铁粉逐渐变黑,吹泡器连续吹出气泡,且气泡向上飞起;用燃着的木条靠近气泡,能产生爆鸣。该气体燃烧的化学方程式是_______。
(3)同学们讨论后认为:铁与水蒸气反应生成的固体是“铁的一种氧化物”,玻璃管内的黑色固体中还可能含有“过量的铁”。
(查阅资料)铁有三种氧化物,FeO(黑色、无磁性)、Fe2O3(红棕色、无磁性)、Fe3O4(黑色、有磁性);铁的三种氧化物都不与硫酸铜溶液反应。
(实验探究)
实验步骤 | 实验现象 | 实验结论 |
①取上述黑色固体少许,装入试管,加入足量硫酸铜溶液 | 有红色固体出现 | 黑色固体中一定含有______ |
②过滤第①步的产物,将所得固体干燥,用磁铁接触该固体 | 固体可以被磁铁吸起 | 黑色固体中一定含有_______ |
(探究结论)铁与水蒸气发生置换反应,有关的化学方程式是_______。
(拓展创新)同学们利用微型仪器“长柄V形玻璃管”改进了图甲装置,设计出图乙装置,并分别选用湿棉布、湿粉笔、芦荟叶、氢氧化铜等作为供水剂,实验都获得成功。
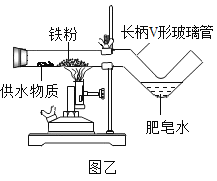
①甲、乙装置相比,乙装置有很多优点,请你写出一条。_____。
②用化学方程式解释氢氧化铜供水的原理:______。
(4)某磁铁矿石含Fe3O480%。若冶炼336t铁,则理论上需该铁矿石多少吨?_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com