
【题目】已知,标准状况下二氧化碳的密度可表示为44/22.4g/L。将CO2通入NaOH溶液中,所得产物随通入的CO2的质量的不同而不同。完成下列填空。
(1)向NaOH溶液中通入CO2,先发生反应_____(用方程式表示),继续通入,又发生反应_____。
(2)250g质量分数4%的NaOH溶液,最多可吸收CO2的体积为_____L(标准状况下)。
(3)向250质量分数8%的的NaOH溶液中通入一定量CO2,溶液增重4.4g,将所得溶液蒸干,计算所得固体中各成分以及其质量为_____。
(4)向未知浓度、体积为VL的NaOH溶液中缓缓通入一定体积(标准状况下)的CO2,充分反应后,CO2和NaOH均无剩余,再向溶液中加入过量的澄清石灰水生成m1g白色沉淀。根据以上数据,用代数式表示CO2的体积V(CO2)=_____。
【答案】![]()
![]() 5.6L NaOH 12g Na2CO3 10.6g 0.224m1L
5.6L NaOH 12g Na2CO3 10.6g 0.224m1L
【解析】
(1)向NaOH溶液中通入CO2,氢氧化钠先与二氧化碳反应生成碳酸钠和水,该反应的化学方程式为:![]() ,继续通入二氧化碳,碳酸钠会与二氧化碳、水反应生成碳酸氢钠,该反应的化学方程式为:
,继续通入二氧化碳,碳酸钠会与二氧化碳、水反应生成碳酸氢钠,该反应的化学方程式为:![]() ;
;
(2)当二氧化碳不足时,发生的反应:![]() ,当二氧化碳过量时,发生的反应:
,当二氧化碳过量时,发生的反应:![]() ,
,![]() ,二氧化碳过量时,该反应的总方程式为:
,二氧化碳过量时,该反应的总方程式为:![]() ;由化学方程式可知,二氧化碳过量时,参加反应的氢氧化钠与二氧化碳的质量比为:40:44,二氧化碳不足时,参加反应的氢氧化钠与二氧化碳的质量比为:80:44,故二氧化碳过量时,吸收二氧化碳的质量最大,设最多可吸收CO2的体积为x
;由化学方程式可知,二氧化碳过量时,参加反应的氢氧化钠与二氧化碳的质量比为:40:44,二氧化碳不足时,参加反应的氢氧化钠与二氧化碳的质量比为:80:44,故二氧化碳过量时,吸收二氧化碳的质量最大,设最多可吸收CO2的体积为x

![]() x=5.6L
x=5.6L
(3)向250g质量分数8%的的NaOH溶液中通入一定量CO2,溶液增重4.4g,增加的质量就是参加反应的二氧化碳的质量,![]() ,参加反应的氢氧化钠与二氧化碳的质量比为:80:44,设250g质量分数8%的的NaOH溶液完全反应,吸收二氧化碳的质量为x,80:44=(250g×8%):x,x=11g>4.4g,故氢氧化钠过量,将所得溶液蒸干,所得固体为碳酸钠和氢氧化钠的混合物,设参加反应的氢氧化钠的质量为m,生成碳酸钠的质量为n
,参加反应的氢氧化钠与二氧化碳的质量比为:80:44,设250g质量分数8%的的NaOH溶液完全反应,吸收二氧化碳的质量为x,80:44=(250g×8%):x,x=11g>4.4g,故氢氧化钠过量,将所得溶液蒸干,所得固体为碳酸钠和氢氧化钠的混合物,设参加反应的氢氧化钠的质量为m,生成碳酸钠的质量为n
![]() m=8g
m=8g
![]() n=10.6g
n=10.6g
所得固体中氢氧化钠的质量为:250g×8%-8g=12g
碳酸钠的质量为10.6g;
(4)向未知浓度、体积为VL的NaOH溶液中缓缓通入一定体积(标准状况下)的CO2,充分反应后,CO2和NaOH均无剩余,再向溶液中加入过量的澄清石灰水生成m1g白色沉淀,可能发生的反应为:![]() ,
,![]() ,
,![]() ,
,![]() ,由化学方程式可知,生成的白色沉淀是碳酸钙,二氧化碳中的碳元素全部转到了碳酸钙中,根据质量守恒定律,化学反应前后,元素的质量不变,碳酸钙中碳元素的质量为:
,由化学方程式可知,生成的白色沉淀是碳酸钙,二氧化碳中的碳元素全部转到了碳酸钙中,根据质量守恒定律,化学反应前后,元素的质量不变,碳酸钙中碳元素的质量为:![]() ,通入二氧化碳的质量为:
,通入二氧化碳的质量为:![]() ,通入二氧化碳的体积为:
,通入二氧化碳的体积为:![]() 。
。


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案科目:初中化学 来源: 题型:
【题目】根据要求回答问题。
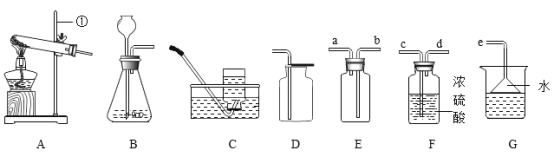
(1)写出仪器①的名称_______。
(2)用向上排空气法收集到的气体,检验是否为氧气的操作是_____________。
(3)通常状态下,HCl是一种无色有刺激性气味的气体,密度比空气大,极易溶于水形成盐酸。用如图所示装置收集一瓶干燥的HCl,装置的导管按气流方向连接的顺序是:气体→_____→_____→_____→_____→e(填字母)。
(4)G装置烧杯中的水改成氢氧化钠溶液可吸收污染物五氧化二磷,生成磷酸钠(Na3PO4)和水,反应的化学方程式为_______________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有FeCl3和CuCl2的混合溶液195.2g,向其中加入铁粉,反应的先后顺序为:2FeCl3+Fe═3FeCl2CuCl2+Fe═FeCl2+Cu.加入铁粉质量与反应就溶液中剩余固体质量的关系如图所示.
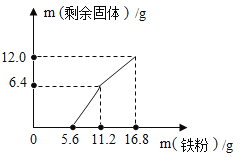
(1)m(剩余固体)>6.4g时,剩余固体的成分是______________(填化学式),此剩余固体加入盐酸,发生反应的化学方程式为______________.
(2)原FeCl3和CuCl2的混合溶液中FeCl3的质量为______________g.
(3)求当加入11.2g铁粉时,反应后所得溶液中FeCl2的质量分数(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小明同学在验证稀硫酸性质时用到了有毒的BaCl2进行如下实验,回答下列问题:
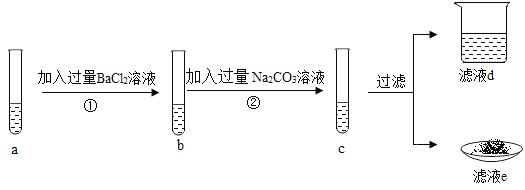
(1)步骤①中发生反应的化学方程式_____。
(2)向滤液D中滴入石蕊并振荡,溶液颜色呈_____色。
(3)下列说法中,正确的是_____。
A.a试管中的液体可直接干燥CO2气体
B.将b试管中混合物过滤,滤液可用于鉴别Na2SO4和Mg(NO3)2两种无色液体
C.若向c试管中加入足量稀盐酸,沉淀全部溶解且有气泡产生
D.滤液d与适量的石灰水混合可制取NaOH溶液
E.理论上,滤渣e可用于医疗上的“钡餐”检查
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某些盐在溶液中结晶时,析出的晶体是结晶水合物。下表记录了t°C时向4份相同的硫酸铜溶液中加入的无水硫酸铜的质量以及析出硫酸铜晶体(CuSO4·5H2O)的质量的实验数据:
硫酸铜溶液 | Ⅰ | Ⅱ | III | IV |
加入的无水硫酸铜(g) | 2.5 | 4.0 | 6.0 | 8.0 |
析出的硫酸铜晶体(g) | 0.10 | 2.8 | 6.4 | 10.0 |
当加入4.6g无水硫酸铜时,析出硫酸铜晶体的质量为( )
A.2.56gB.3.42g
C.3.88gD.6.82g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小张同学利用图 1 装置研究稀盐酸与氢氧化钠溶液反应的过程,并用 pH 和温度传感器测量反应过程中相关物理量的变化情况,记录得到图 2 和图 3。
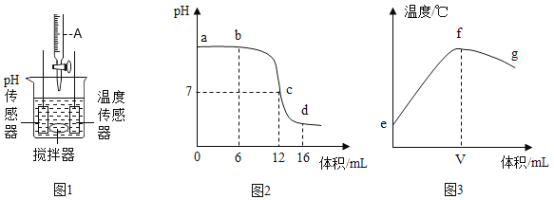
据此,小张同学得到以下结论:
①图 1 的仪器 A 中盛放的是氢氧化钠溶液;
②图 2 中 b 点所示溶液中的溶质是 NaCl 和 NaOH;
③将图 2 中 d 点所示溶液加热蒸干所得固体为纯净物;
④图 2 中 c→d 所示溶液中 NaCl 的质量不断增加;
⑤图 3 中 V 的数值最接近 12;
⑥由图 3 中 e→f 的变化趋势可说明该反应是放热反应。 以上描述中,正确的是:
A.①④⑥B.②④⑤⑥C.②③⑤⑥D.②③④⑤⑥
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某兴趣小组用如图 1 装置进行实验时发现:烧杯中饱和石灰水先变浑浊,后逐 渐澄清。
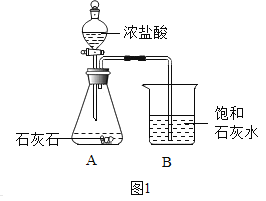
(1)写出 B 装置中饱和石灰水变浑浊的化学方程式____________。
(2)为探究“饱和石灰水浑浊后变澄清的原因”,该小组同学开展了如下活动:
(查阅文献)①碳酸钙(碳酸钠等)与二氧化碳、水反应生成可溶于水的碳酸氢钙(碳酸氢 钠等);
②AgCl 不溶于稀硝酸。
(提出假设)
假设 1:挥发出的 HCl 使浑浊变澄清;
假设 2:CO2 过量,使碳酸钙沉淀转化为可溶性的碳酸氢钙。
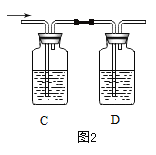
(设计实验)为检验并除去 CO2 中的 HCl,小华在图 1 中 A、B 装置之间增加图 2 装置,请 选择合适试剂依次注入装置 C、D 中,你的选择是____________(填字母)。
A.AgNO3 溶液饱和 NaHCO3溶液 B.饱和 NaHCO3溶液 AgNO3 溶液
(实验现象)饱和石灰水浑浊后,继续通入经除杂处理的 CO2,沉淀完全溶解最终完全澄清。
(得出结论)由于 CO2过量,碳酸钙沉淀转化为可溶性的碳酸氢钙,所以饱和石灰水先浑 浊后澄清。
(实验拓展一)足量 CO2 与 NaOH 溶液的反应情况探究
已知 20℃时部分物质的溶解度数据。
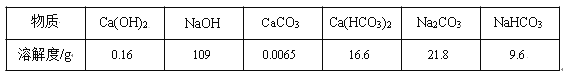
(3)20℃时向一定质量溶质质量分数为 10%的氢氧化钠溶液中持续通入 CO2 直至过量,先生成 Na2CO3,再转化为 NaHCO3,总的反应方程式为 CO2+NaOH = NaHCO3,观察到 有白色沉淀生成,根据溶解度数据判断,该白色沉淀是____________ (填名称)
(4)根据化学方程式 CO2+NaOH = NaHCO3 计算:理论上吸收 4.4g CO2,需溶质质量分数 为 10%的氢氧化钠溶液的质量至少为多少克? (写出完整计算过程)____________
(5)同学们为了完成上述实验,需要将实验室现有的 50g 溶质质量分数为 40%的 NaOH 溶液配制成该溶质质量分数为10%的 NaOH 溶液,稀释过程中,需要用量筒取水____________ mL(水的密度可看作为 1g/cm3)。
(实验拓展二)CO2性质的再探究 二氧化碳的用途之一是灭火,但当钠燃烧时,二氧化碳不仅不能灭火,反而会使燃烧更加剧烈。
(查阅资料)钠燃烧会生成过氧化钠(Na2O2),过氧化钠是一种淡黄色固体,常温下与二氧 化碳或水都能发生反应。
(提出问题)为什么燃烧会更加剧烈?二氧化碳和过氧化钠反应生成了什么物质?
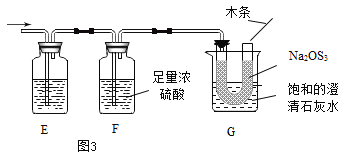
(实验探究)将上述二氧化碳发生装置与图 3 相连接,过一段时间后,G 烧杯中饱和的澄清石灰水变浑浊,a处带火星的小木条复燃。
(实验分析)装置 F 的作用是____________。G烧杯中饱和的澄清石灰水变浑浊的原因是______。
(实验结论)二氧化碳和过氧化钠反应生成氧气能使燃烧更加剧烈。结合所学知识得出CO2与 Na2O2 反应的生成物为____________ (填字母)
a.Na2O 和 O2 b.NaOH 和 O2 c.Na2CO3 和 O2 d. NaHCO3 和 O2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据如下图所示实验回答问题。
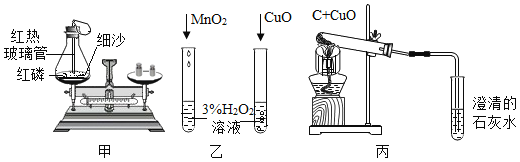
(1)甲是利用红磷燃烧探究质量守恒定律的实验,气球的作用是_________________,实验过程中,气球先后发生的变化是______________________________。
(2)乙实验的目的是__________________________________。
(3)丙实验中金属网罩的作用是____________________;实验结束,要先将导管从石灰水中取出,再熄灭酒精灯,目的是_______________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】一包白色粉末A由Na2SO4、NaOH、Ba(OH)2、BaCO3、 MgC12五种物质中的两种或多种混合而成。为探究其组成,进行如下图所示的实验: (假设 实验过程中所发生的反应均恰好完全反应)
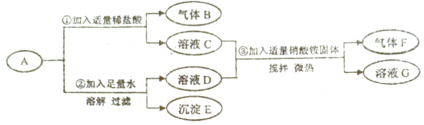
依据实验过程和出现的现象请你回答下列问题:
(1)气体F的化学式是_______。
(2)写出步骤①中生成气体B的化学方程式:______。
(3)在溶液C和溶液G中,一定都存在的阴离子是_____(写离子符号)。
(4)固体混合物A中,肯定不存在的物质有______种。若要进一步推理A的组成,可用溶液D再做实验确定可能含有的物质:
实验操作 | 实验现象 | 实验结论 |
取溶液D少许,滴加Na2SO4溶液,震荡 | 有白色沉淀生成 | ______ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com