
【题目】过氧化氢在生产生活中有着广泛的应用。化学实验小组对过氧化氢的某些性质进行了研究。
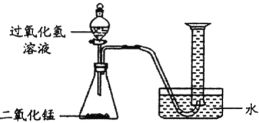
Ⅰ.不稳定性
(1)如图所示进行实验(还测量收集的氧气体积),过氧化氢分解的化学方程式为_________________。
(2)能用排水法收集氧气的原因是 _________________________。
(3)已知:常温常压下,氧气的密度为1. 33 g·L–1。实验小组称量了10 g溶质质量分数为 6%的过氧化氢溶液进行实验,如果将该过氧化氢溶液一次性全部放入锥形瓶中,则选择规格为________mL(选填“50”、“200”或“250"”)的量筒收集氧气较为合适。
(4)实验小组同学还探究了温度对过氧化氢分解速率的影响,相关实验数据如下表:
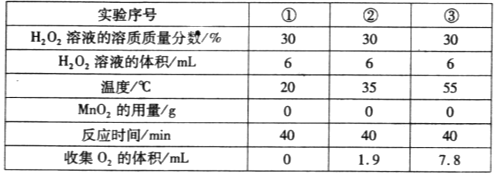
由此得出的结论是_________________________。
Ⅱ.腐蚀性
(查阅资料)H2O2溶液有一定的腐蚀性。
(进行实验)将铜片分别浸泡在以下3种溶液中进行实验,实验现象如下表:
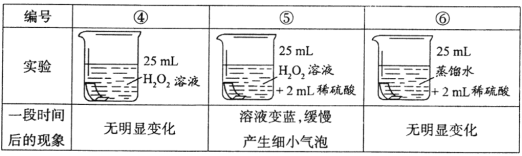
(解释与结论)
(5)实验④的作用是________________。
(6)实验⑤中铜片被腐蚀的反应为Cu + H2O2+ H2SO4=CuSO4+□________,请补全该反应的化学方程式。
(反思交流)
(7)小红同学提出,实验⑤中除发生(6)所给的反应外,还发生了另一个反应导致有细小的气泡产生,该反应的反应物是_______________________。
【答案】2H2O2![]() 2H2O+O2↑ 氧气不易溶于水 250 温度越高,过氧化氢分解的越快 对照实验 2H2O 过氧化氢
2H2O+O2↑ 氧气不易溶于水 250 温度越高,过氧化氢分解的越快 对照实验 2H2O 过氧化氢
【解析】
(1)如图所示进行实验,过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,化学方程式为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(2)能用排水法收集O2的原因是:氧气不易溶于水;
(3)设生成氧气的质量为x,
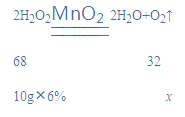
![]()
x=0.282g,
得到氧气的体积=0.282g![]() 1. 33 g·L–1=212mL,应选250mL的量筒;
1. 33 g·L–1=212mL,应选250mL的量筒;
(4)探究温度对过氧化氢分解速率的影响,由表格得出的结论是:温度越高,过氧化氢分解的越快;
(5)实验④的作用是对照实验;
(6)铜片被腐蚀的反应是:铜和过氧化氢和稀硫酸反应生成硫酸铜和水,Cu+H2O2+ H2SO4=CuSO4+2H2O;
(7)过氧化氢在二氧化锰做催化剂的条件下生成水和氧气。


科目:初中化学 来源: 题型:
【题目】铁是目前使用最广泛的金属。请回答下列问题。
(1)身体一旦缺铁可能患有的疾病是__________。
(2)工业炼铁的主要设备是_________。工业上选用赤铁矿(主要成分Fe2O3)为原料炼铁的化学反应方程式为_________。
(3)不锈钢是铁、铬(Cr) ,镍(Ni)的合金,常用来制造医疗器械、餐具等。通过实验得知,铬和镍两种金属都能与稀硫酸反应生成氢气,分别得到硫酸铬(CrSO4)和硫酸镍(NiSO4)溶液。请写出铬(Cr)与稀硫酸反应的化学方程式_______________。
(4)铁生锈的主要过程为![]()
Ⅰ.写出转化①的化学方程式_________________。
Ⅱ.转化③生成![]() ,则x≤______________(x为整数)。
,则x≤______________(x为整数)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】镓是一种奇妙的金属,放在手心马上熔化,犹如荷叶上的水珠流来流去。

请阅读信息后回答:
(1)金属镓________________(填物理性质);(2)图中镓的相对原子质量是___________;
(3)镓原子结构示意图中X的数值为__________;(4)镓的氧化物的化学式___________;
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)是一种高效多功能净水处理剂,工业上常采用次氯酸钠(NaClO)氧化法生产,反应原理用化学方程式表示为: 3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O
(1)次氯酸钠(NaClO)的相对分子质量为__;其中氯元素的化合价为__;
(2)高铁酸钠(Na2FeO4)中铁元素和氧元素的质量比为____(填最简比);
(3)现要制得830kg含杂质20%的高铁酸钠,至少需要次氯酸钠的质量是多少__________?(列式计算)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)已知某混合物由氧化铁、氧化亚铁和碳酸钙三种物质组成,其中铁元素的质量分数为28%,则碳酸钙的质量分数(用字母W表示)范围为____________
(探究)某同学为了测定10g该混合物中碳酸钙的质量分数,设计了如下图1的实验,请回答下列问题:(已知:浓硫酸有吸水性,可以作气体干燥剂)
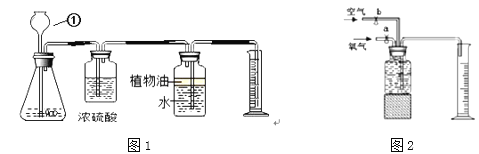
(2)仪器①的名称是_____________
(3)锥形瓶内装入的液体是稀盐酸,则生成气体的化学方程式____________________
(4)要得到准确的实验结果除了要知道进入量筒内液体的体积,还必须测量的数据是_______
(5)若实验结束后需要回收锥形瓶内的残留固体物,还需要进行的操作是________
(6)某同学用如图2所示装置收集体积分数为60%的氧气(假设集气瓶中水被全部排入量筒中),则通入的氧气和空气的体积比大约是(整数比) ________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组受“2018环泉州湾国际公路自行车赛”启示,设计如下模拟赛道进行化学知识复习。“赛道”上A、B、C、D、E为初中化学常见物质,A为固体物质,E为可燃性气体。
(1)若“赛道”上相邻物质之间能发生化学反应,A为大理石的主要成分,D能支持E的燃烧。
① B溶液中所含的溶质为______。
② 若C与D反应发出耀眼白光,有关反应的化学方程式可能为______。
③ 从燃烧的条件考虑,要使E在D中燃烧还需要满足的条件是______。
(2)若“赛道”上 A、B、C、D 四种物质均能在一定条件下分解生成氧气,用B或C制取氧气所需的催化剂可由A分解制得;C可生成D,D可生成E。
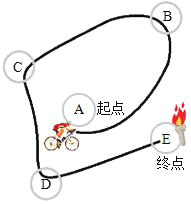
① B的化学式为______。
② D转化为E的化学方程式为______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学向100.00g水中加入0.56g氧化钙(见下图A),并设计了后续实验方案:
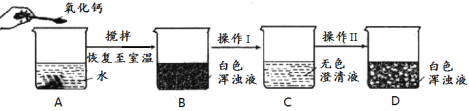
(1)氧化钙的俗称是___________。
(2)A中发生的反应的化学方程式为___________。
(3)在室温下,将B中白色浑浊液变为C中无色澄清液的“操作I”的名称是_________。
(4)测得C中液体质量仍为100.00g,则其中溶质的质量分数为______(保留两位小数)。
(5)如操作II为通入一种气体,则发生反应的化学方程式为 __________。
(6)如操作II为加入少量某固体,则该固体可能是_______(填序号)。
①氧化钙 ②冰块 ③氯化钠 ④氢氧化钠
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在一定条件下,在一个密闭容器内发生某反应,测得反应过程中各物质的质量如表所示,下列说法不正确的是( )
物质 | X | Y | Z | W |
反应前质量/g | 10 | 3 | 90 | 0 |
反应后质量/g | 3.2 | 3 | 待测 | 3.2 |
A. W可能是单质 B. Y可能是催化剂
C. 该反应是分解反应 D. 反应后Z物质的质量为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com