
 在学习了金属活动性顺序的知识后,小华想在实验室里通过实验验证一下Zn、Fe、Cu三种金属的活动性,设计了如下实验:
在学习了金属活动性顺序的知识后,小华想在实验室里通过实验验证一下Zn、Fe、Cu三种金属的活动性,设计了如下实验:| 试管编号 | 1 | 2 | 3 |
| 反 应 物 | Zn片+稀H2SO4 | Fe片+稀H2SO4 | Cu片+稀H2SO4 |
| 反应现象 | 气泡多、大、上升快 | 气泡细小,上升慢 | 没有气泡 |


科目:初中化学 来源: 题型:
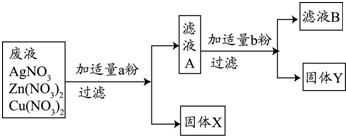
查看答案和解析>>
科目:初中化学 来源: 题型:
| 操 作 步 骤 | 实 验 现 象 |
| ①将一小块钠放入盛水的烧杯中 | 剧烈反应,金属溶解,产生大量气体 |
| ②向反应后的烧杯中滴加酚酞试液 | 酚酞试液变红 |
| ③将产生的气体收集并点燃 | 该气体能燃烧,并产生淡蓝色火焰 |
| ||
| ||
查看答案和解析>>
科目:初中化学 来源:2013-2014学年浙江嘉兴嘉善县实验中学等10校九年级上学期期中联考化学试卷(解析版) 题型:探究题
在学习了金属活动性顺序的知识后,小华想在实验室里通过实验验证一下Zn、Fe、Cu三种金属的活动性,设计了如下实验:
①取相同形状的铁片、锌片、铜片,分别用砂纸打磨至光亮,放入试管中。
②分别加入5毫升20%的稀硫酸,观察现象并记录到下面的表格中。
|
试管编号 |
1 |
2 |
3 |
|
反 应 物 |
Zn片+稀H2SO4 |
Fe片+稀H2SO4 |
Cu片+稀H2SO4 |
|
反应现象 |
气泡多、大、上升快 |
气泡细小,上升慢 |
没有气泡 |
(1)根据小华的实验设计可知,他是通过 来判断金属活动性的。
(2)在实验过程中,细心的小华还发现了二个有趣现象①试管发烫,②反应的速度随时间而变化,他粗略的用图像画了下来(如下图)。反应速度为什么会这样变化呢?科学老师给了他一个启示:化学反应的速度跟反应温度、反应物的溶质质量分数有关。经过思考小华给出了一个合理的解释 。

(3)对于验证三种金属的活动性,小明提出了一个 更简单的方案:把锌片、铜片分别放入 溶液,通过观察反应的现象就可以了。
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 操 作 步 骤 | 实 验 现 象 |
| ①将一小块钠放入盛水的烧杯中 | 剧烈反应,金属溶解,产生大量气体 |
| ②向反应后的烧杯中滴加酚酞试液 | 酚酞试液变红 |
| ③将产生的气体收集并点燃 | 该气体能燃烧,并产生淡蓝色火焰 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com