
【题目】空气是人类最宝贵的自然资源.空气中氮气的含量最多,氮气在高温、高能量条件下可与某些物质发生反应.图1是以空气和其他必要的原料合成氮肥(NH4HCO3)的流程.请按要求回答下列问题:

(1)步骤①中可利用氮气和氧气的__________不同分离出氮气和氧气。分离液态空气可得到合成氨所需要的氮气,是___________变化(填“物理”或者“化学”)。
(2)写出步骤②中发生反应的符号表达式___________________________________。
(3)图2是化肥碳酸氢铵包装袋上的部分说明:碳酸氢铵具有的性质是________(填字母).
A.易溶于水 B.有挥发性 C.受热易分解
(4)这种化肥含氮量是否达到16%?带着问题,兴趣小组的同学取了一些化肥样品,进入实验室.
(查找资料)
①碱石灰能够吸收水和CO2,但是不吸收NH3.
②浓硫酸能吸收NH3但是不吸收CO2.
③氨气溶于水形成氨水
(性质探究)该同学设计了如下的实验装置:

①用A装置给碳酸氢铵加热,装药品前,必须进行的一步操作是_______________。
②取适量碳酸氢铵加入试管,连接A、C、E装置,加热,E中的现象是_____________。
③连接A、B装置,继续加热,观察到试管口的现象是____________证明有水生成;B中的现象是______________________________________证明有二氧化碳生成。
④碳酸氢铵在受热时发生反应的符号表达式是___________________________________。
(含量分析)将装置A、C、D依次连接,加入20g化肥样品,加热至A中固体完全消失.
她称量装置D的质量如表:
实验前D装置的质量 | 149g |
实验后D装置的质量 | 152.4g |
⑤由此分析得知:反应中产生氨气的质量为__________g。
⑥通过反应的表达式可以知道:氨气中氮元素全部来自于碳酸氢铵(假设杂质中不含氮元素),请计算此化肥含氮元素质量分数为____________。
【答案】沸点 物理 H2+N2→NH3 AC 检查装置的气密性 酚酞溶液变红 有水珠出现 澄清石灰水变浑浊 NH4HCO3![]() NH3↑+H2O+CO2↑ 3.4g 14%(无过程不给分)
NH3↑+H2O+CO2↑ 3.4g 14%(无过程不给分)
【解析】
(1)分离液态空气得到氮气和氧气是利用了空气中各成分的沸点不同,故填沸点。
(2)分离液态空气利用了空气中各成分的沸点不同采用蒸发的方法得到合成氨所需要的氮气,蒸发属于物理变化,故填物理变化。
(3)步骤②中发生的反应是氢气和氮气反应生成氨气,故符号表达式写为:H2 + N2→NH3。 (4)化肥碳酸氢铵包装袋上的部分说明知保存时防潮,使用时避免高温,说明碳酸氢铵易溶于水、受热易分解,故选AC。
(5)气体发生装置在加入药品前要检查装置的气密性防止气体泄露,故填装置的气密性。
(6)A中碳酸氢铵受热分解生成氨气、水和二氧化碳,C中碱石灰能够吸收水和CO2,但是不吸收NH3,进入E装置的气体只有氨气,氨气溶于水形成氨水,氨水显碱性使无色酚酞试液变红,故填酚酞溶液变红。
(7)A中生成水,水受热形成水蒸气,水蒸气运动到试管口处遇冷成水珠,故填有水珠出现。
(8)二氧化碳气体能与澄清石灰水中的氢氧化钙反应生成难溶性的碳酸钙使石灰水变浑浊,故填澄清石灰水变浑浊。
(9)碳酸氢铵在加热的条件下反应生成氨气、水和二氧化碳,故文字表达式写为:NH4HCO3![]() NH3↑+ H2O + CO2↑。
NH3↑+ H2O + CO2↑。
(10)碱石灰吸收水和二氧化碳,浓硫酸吸收氨气,所以实验装置D增加的质量就是氨气的质量,所以氨气质量为152.4g -149g = 3.4g,故填3.4g。
(11)解:氮元素的质量为
3.4g×![]() ×100% = 2.8g
×100% = 2.8g
化肥含氮元素质量分数为
![]() ×100% = 14%
×100% = 14%
答:此化肥含氮元素质量分数为14%。


 学习实践园地系列答案
学习实践园地系列答案科目:初中化学 来源: 题型:
【题目】小兰同学在学习“水的净化”时,在家里自制了净水装置,如图所示,下列说法中不正确的是( )
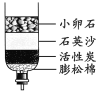
A. 小卵石、石英砂、膨松棉所起的作用是过滤作用
B. 活性炭所起的作用是吸附水中的色素和气味
C. 若是硬水经过此装置过滤将变为软水
D. 若是浑浊的河水经过该装置后,变得澄清了,但依然是混合物
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某实验小组欲证明氧化铜能加快氯酸钾的分解,并与二氧化锰的催化效果进行比较用如图装置进行实验,实验时均以生成25mL气体为准,其它可能影响实验的因素均已忽略,相关数据见下表:
(探究Ⅰ)
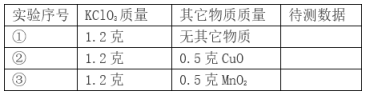
(1)按上图装置仪器组装后,装药品前,首先要做的实验是__________________________。若要证明实验②中球形干燥管内收集的气体是氧气,可待气体收集结束后,用弹簧夹夹住B中乳胶管,拔去干燥管上的单孔橡皮塞,把带火星的木条伸入球形干燥管内,木条复燃,证明是氧气;。
(2)实验①和②的目的是______________________________。
(3)为探究CuO在实验②中是否起催化作用,需再做如下实验(无需写出具体操作): a.__________________,b. CuO的化学性质在反应前后有没有改变。
(4)上述实验中的“待测数据”指___________________________________________,若______________说明MnO2比CuO对氯酸钾的催化效果好。
(5)写出氯酸钾被CuO催化分解的符号表达式__________________________。
(探究Ⅱ)研究表明,许多金属氧化物对氯酸钾的分解有催化作用。分别用下列金属氧化物作催化剂,氯酸钾开始发生分解反应和反应剧烈时的温度如下表所示:
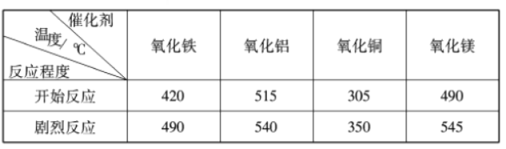
(1)实验室用氯酸钾制取氧气,如果不用二氧化锰作催化剂,最好选用_________(填序号)。
A.氧化铁 B.氧化铝 C.氧化铜 D.氧化镁
(2)实验室加热氯酸钾制氧气时,忘记加入二氧化锰,其结果是___________(填序号)。
A.不能产生氧气 B. 生成氧气的速率慢 C. 产生氧气的总量减少
(探究Ⅲ)
铜的氧化物除了氧化铜(CuO)还有氧化亚铜(Cu2O),请计算:
(1)氧化亚铜的相对分子质量是_____________。
(2)28.8g氧化亚铜中含有__________g铜元素。
(3)当氧化铜与氧化亚铜含铜元素质量相等时,氧化铜与氧化亚铜的质量比是___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学实验室制取气体的部分仪器或装置如图所示,请回答下列问题:
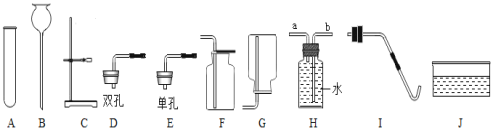
(1)仪器J的名称___________:
(2)若用氯酸钾和二氧化锰制取氧气,必须要增加的一种仪器是________;该反应的符号表达式为______________:。若用装置H收集氧气,氧气应从_____(填“a”或“b”)端通入,若用F装置收集氧气,验满的方法是_______。
(3)某同学用上述(2)中的方法制取氧气,实验过程中试管发生了炸裂,请你帮他分析试管炸裂可能的原因是__________(写一条即可)。
(4)若用过氧化氢溶液和二氧化锰制取并收集干燥的氧气,需要的仪器是______(填字母从A—J中选择),该反应的符号表达式为________。
(5)氨气是一种密度小于空气,极易溶于水的气体,溶于水形成的溶液可以使酚酞试液变红。实验室可用加热氢氧化钙和氯化铵固体混合物的方法制取氨气,实验室可用______方法收集氨气,如果选用如图装置进行制备并验证氨气的性质,当实验开始一段时间之后你会发现酚酞试液变红,且可以看到燃着的蜡烛熄灭。根据信息你认为:玻璃导管没有伸入酚酞试液中的原因是_______;蜡烛熄灭说明氨气_________(填化学性质,任写一条)。

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】结合下列化学实验装置,回答有关问题。
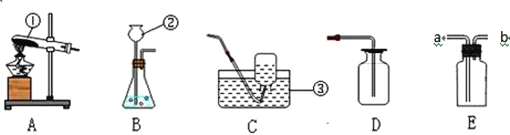
(1)写出带有标号②的仪器名称________ 。
(2)实验室用高锰酸钾制取氧气的符号表达式是 ______,其基本反应类型为 _______,用A做发生装置时,应作何改进_____。要收集较为纯净的氧气,应选择的收集装置为_________,利用该装置判断集气瓶内氧气是否收集满的依据是_______。若E中装满水,则收集氧气时气体应从________(a或b)端通入。
(3)硫化氢(H2S)气体是一种密度比空气大,能溶于水的有毒物质,其水溶液叫氢硫酸.实验室常用硫化亚铁(FeS)固体和稀硫酸溶液在常温下发生反应制取硫化氢气体,应选择的发生装置是_______,硫化氢可以燃烧,燃烧后生成一种有刺激性气味的气体和一种常见液体,请写出该反应的符号表达式_____,小虹同学认为收集硫化氢气体可用D或E装置,但小娟提出了质疑,小娟的理由是_______。
(4)为了测定空气中氧气含量, 小明小组设计了如图的装置进行探究活动。
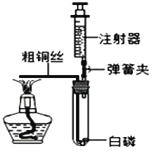
(步骤与现象)
①试管的容积为50mL;
②检查装置的气密性良好;
③装药品,将注射器活塞调整到合适位置,连接好仪器;
④弹簧夹夹紧胶皮管,加热粗铜丝,观察现象;
⑤燃烧结束,试管冷却到室温后打开弹簧夹,观察注射器活塞的移动情况。
(反思与交流)(1)兴趣小组同学测量试管容积的方法可能是________;
(2)小华同学认为步骤⑤在保证活塞自由移动的前提下,观察活塞位置时,最好将试管和注射器整体横放,小华同学的理由是________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“化学反应条件的控制是实验灵魂”。小林和同学在老师指导下,探究了“影响过氧化氢分解速度的因素”。
(实验)
(1)取两支大试管,分别倒入适量的5%、10%的过氧化氢溶液,再加入等量的二氧化锰,各收集一集气瓶气体,发现浓度大的先收集满。该操作过程中合理的排列顺序____________。(选填序号)
①检验装置的气密性 ②旋紧连有导管的单孔塞
③将水槽中待收集气体的集气瓶注满水 ④有连续稳定气泡再排水集气
⑤向大试管内倒入适量过氧化氢溶液再加入少许二氧化锰粉末
(2)取a 、b两支试管加入等体积5%的过氧化氢溶液,再分别加入少许二氧化锰粉末、氧化铜(CuO)粉末,发现a 中比b中产生气泡多且快。随即用带火星的木条分别悬空伸入试管内,发现a中火星复燃,b中火星仅发亮但不复燃。
( 结论)
根据实验(1)(2)得出影响过氧化氢溶液分解的因素是________________、_____________。
(反思) “红砖粉末是否也可以作过氧化氢分解的催化剂?”
(实验)实验步骤和现象如下:
①小林分别向两支试管中加入等质量等浓度的过氧化氢溶液,向其中一支试管加入一药匙红砖粉末,然后将两支试管中的气体通入水中比较产生气泡的快慢,发现加入红砖粉末的试管中反应较快。
②将反应较快的试管内固体过滤出来,洗涤、烘干。
③用烘干后的固体重复步骤①的实验,现象与步骤①完全相同。
试回答:步骤③的实验目的是___________________________。小林认为通过上述实验已证明红砖粉末可以作过氧化氢分解反应的催化剂,但老师认为小林同学的实验还缺少一个关键步骤,请指出来_______________________________________。
(拓展提高)
小林在实验时,联想到了卖鱼卖虾的商贩用过氧化钙(CaO2)增加水池中的含氧量,于是提出如下猜想.
(猜想)过氧化钙与水反应可制取氧气.
实验装置 | 实验主要过程 |
| ①检查装置气密性. ②加入过氧化钙和水后,有少量细小气泡缓慢放出,在导管口几乎收集不到气体.该装置放置到第二天,集气瓶中只收集到极少量气体,震荡试管后仍有少量细小气泡缓慢放出. |
实验结论:过氧化钙与水反应____________(填“能”或“不能”)用于实验室制取氧气.
(分析与反思)
(1)过氧化钙与水反应虽然没有快速收集到大量氧气,但由此实验现象,小林认为商贩用过氧化钙做增氧剂的主要原因是______________________.
(2)小林希望对此实验进行改进,使该反应加快,请你帮他提出合理化建议_____________.
(计算)该兴趣小组的同学们购得用于增氧的过氧化钙产品(杂质不含钙元素),标签如图所示.试计算:

(1)过氧化钙的相对分子质量为_____________;
(2)过氧化钙中钙元素与氧元素的质量比为____________;
(3)过氧化钙与水反应生成氢氧化钙和氧气,______g过氧化钙与37g氢氧化钙含钙量相当;
(4)该产品(如图)中过氧化钙的质量分数至少为_____________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】过氧化氢在生产生活中有广泛应用,实验小组对过氧化氢进行探究。
(一)探究过氧化氢制取氧气
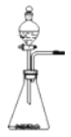
(1)分液漏斗中应放入的物质是_______,锥形瓶中应放入的物质是_______。写出该反应的符号达式__________________________,基本反应类型是_______。
(2)与高锰酸钾加热制取氧气相比,此法优点是_______(填编号)。
① 生成物只有氧气 ② 不需加热 ③ 更环保
(二)微观探究:如图是过氧化氢分解的微观示意图,据图回答:
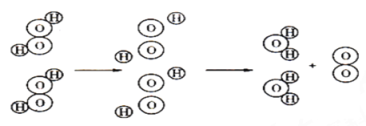
(3)一个过氧化氢分子由__________和____________构成。根据上图可以得出,在化学变化中__________可以再分,而________不能再分。
(三)不稳定性探究:探究温度对过氧化氢分解速率的影响。
晓晓为了探究温度对H2O2分解速率的影响,利用如图所示装置(夹持装置略去)进行实验(水浴是利用热水进行加热),实验数据如下表:
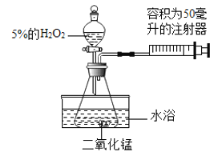
实验1 | 实验2 | |
MnO2的质量/克 | 0.5 | 0.5 |
5%的H2O2的体积/毫升 | 40 | X |
温度/℃ | 20 | 80 |
(4)实验2中X的值应为_______毫升。
(5)实验中可通过___________________________来比较H2O2分解速率的大小。
(6)实验2中水浴温度控制在80℃时,测定的反应速率会比真实值偏大,其原因是_______。
A.锥形瓶内气体受热膨胀 b.收集到的氧气中混有空气
C.温度较高时水蒸发成水蒸气 d.生成更多的氧气
(7)实验结束后若要将MnO2从混合物中分离出来,可采取的方法是_______、洗涤、干燥。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】复习时,常用专题探究的方法学习常见物质的组成与性质,课堂上老师引导我们回顾了几个探究实验。
探究1:研究常见物质组成
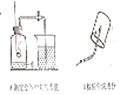
A和B都是研究物质组成的实验。从研究方法得知,A实验是利用可燃物消耗瓶内的____, 使瓶内压强减小来推测空气里氧气含量的: B实验是通过证明生成物的___________来推断甲烷的组成的。
探究2:研究常见物质性质
「资料]氢氧化钠的溶液能够吸收二氧化碳。
步骤1:烧杯中放入氢氧化钠溶液,燃烧匙中放入木炭,
点燃木炭后,迅速将燃烧匙伸入集气瓶,塞紧瓶塞。
步骤2:从注射器中推入适量过氧化氢溶液。实验装置如图所示,请你结合以上资料和实验步骤,回答问题:
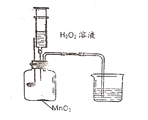
(1)写出木炭燃烧时发生反应的化学方程式:_________。
(2)推入H2O2溶液后,观察到木炭燃烧得更剧烈,由此得出氧气的化学性质是____,据此可知,木炭燃烧的剧烈程度与______有关。
(3)木炭熄灭后冷却一段时间,烧杯中的部分溶液流入集气瓶,请你结合该实验的反应原理分析集气瓶内压强的变化过程是__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
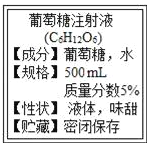
【题目】化学与生活息息相关。
(1)如图是某输液瓶标签上的部分内容.由此可知,葡萄葡萄糖由____种元素组成,葡萄糖的相对分子质量为_________,要把10g这种葡萄糖稀释为2%的溶液,需要加水的质量为______g。
(2)“舌尖上的中国”在央视上的热播,让厨房再次成为人们施展厨艺的舞台。大多数厨师有个工作经验:炒菜时,又加料酒又加醋,可使菜变得香美可口,原因是醋中的乙酸与料酒中的乙醇生成乙酸乙酯。下表中是几种常见的酯,请完成下列问题:
酯的名称 | 甲酸甲酯 | 甲酸乙酯 | 乙酸甲酯 | 乙酸乙酯 |
化学式 | C2H4O2 | C3H6O2 | C3H6O2 | X |
①甲酸甲酯(C2H4O2)中碳元素、氢元素、氧元素的质量比为_______________。
②甲酸乙酯(C3H6O2)中碳元素的质量分数为________(计算结果精确到0.1%)。
③比较归纳是学习化学的重要方法,据表推测X的化学式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com