
【题目】碳酸镁水合物是制备镁产品的中间体。
(制取MgCO3·3H2O)工业上从弱碱性卤水(主要成分为MgCl2)中获取MgCO3·3H2O的方法如下:
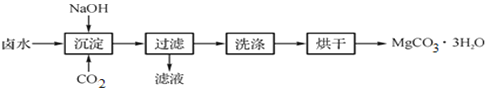
图1 获取MgCO3·3H2O的工艺流程
(1)沉淀过程的化学方程式为:MgCl2+CO2+2NaOH+2H2O![]() MgCO3·3H2O↓+2____。
MgCO3·3H2O↓+2____。
(2)沉淀过程的pH随时间的变化如图2所示,沉淀过程的操作为____(填字母)。
A 向卤水中滴加NaOH溶液,同时通入CO2
B 向NaOH溶液中滴加卤水,同时通入CO2
C 向卤水中通入CO2至饱和,然后滴加NaOH溶液,同时继续通入CO2
D 向NaOH溶液中通入CO2至饱和,然后滴加卤水,同时继续通入CO2
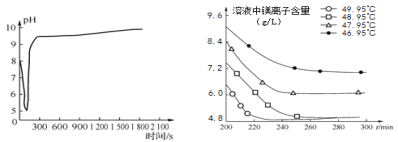
图2 沉淀过程的pH变化 图3 不同温度下溶液中镁离子含量随时间的变化
表1 不同反应温度下的水合碳酸镁
温度(℃) | 产物 |
46.95 | MgCO3·3H2O |
47.95 | MgCO3·3H2O |
48.95 | MgCO3·3H2O |
49.95 | Mg5(OH)2(CO3)4·4H2O |
(3)沉淀过程的溶液中镁离子含量随时间的变化如图3所示,不同温度下所得到沉淀产物如表1所示。则沉淀过程选择的温度为____,理由是____。
(测定MgCO3·3H2O的纯度)
利用下图所示装置(图中夹持仪器略去)进行实验,以确定MgCO3·3H2O的纯度。
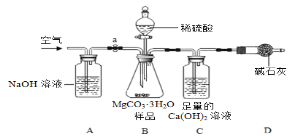
依据实验过程回答下列问题:
(1)实验过程中需持续____(选填“缓缓”或“迅速”)通入空气,其作用除了可搅拌B、C中的反应物外,还有____。D中碱石灰的作用为____。
(2)下列各项措施中,不能提高测定准确度的是____(填标号)。
A 在加入硫酸之前,应排净装置内的CO2气体
B 为了缩短实验时间,快速滴加硫酸
C 在A~B之间增添盛有浓硫酸的洗气装置
D 在C装置左侧导管末端增添多孔球泡
(3)实验中准确称取15.0 g样品三份,进行三次测定,测得中生成CaCO3沉淀的平均质量为10.0 g。请计算样品中MgCO3·3H2O的纯度________
(4)小明认为应将澄清石灰水换成Ba(OH)2溶液,其理由除了Ba(OH)2溶解度大,浓度大,使CO2被吸收的更完全外,还有____。
(5)若获取MgCO3·3H2O的样品中含有少量Mg5(OH)2(CO3)4·4H2O,则样中MgCO3·3H2O的纯度____(填“偏大”或“不变”或“偏小”)
【答案】NaCl C 48.95℃ 此温度下,Mg2+沉淀的速率较快,沉淀效率较高,且不会生成其它沉淀 缓缓 把生成的CO2全部排入C中,使之完全被Ca(OH)2溶液吸收 防止空气中的CO2进入C装置干扰实验 BC ![]() BaCO3的相对分子质量比CaCO3大,等质量的MgCO33H2O生成的BaCO3质量大于CaCO3质量,实验时相对误差小 偏大
BaCO3的相对分子质量比CaCO3大,等质量的MgCO33H2O生成的BaCO3质量大于CaCO3质量,实验时相对误差小 偏大
【解析】
[制取MgCO33H2O]
(1)由反应的化学方程式可知,反应前后镁原子都是1个,碳原子都是1个,氧原子都是6个,氢原子都是6个,反应前氯原子和钠原子都是2个,都包含在未知物质中,因此未知物质是氯化钠。故填:NaCl。
(2)沉淀过程的pH随时间的变化如图2所示,弱碱性卤水的pH大于7,开始时pH逐渐减小,说明加入了二氧化碳,一会儿后pH升高,说明加入了氢氧化钠溶液,同时继续通入二氧化碳,使反应继续进行。故选:C。
(3)由表中数据可知,沉淀过程选择的温度为48.95℃,这是因为此温度下,Mg2+沉淀的速率较快,沉淀效率较高,且不会生成其它沉淀。故填:48.95℃;此温度下,Mg2+沉淀的速率较快,沉淀效率较高,且不会生成其它沉淀。
[测定MgCO33H2O的纯度]
(1)实验过程中需持续缓缓通入空气,其作用除了可搅拌B、C中的反应物外,还有把生成的CO2全部排入C中,使之完全被Ca(OH)2溶液吸收;D中碱石灰的作用为防止空气中的CO2进入C装置干扰实验。
(2)A、在加入硫酸之前,应排净装置内的CO2气体,这样能够防止空气中的二氧化碳和氢氧化钙反应生成碳酸钙,影响实验结果,该选项能提高测定准确度;
B、快速滴加硫酸,可能会导致产生的二氧化碳气体不能被氢氧化钙溶液全部吸收,从而导致实验结果不准确,该选项不能提高测定准确度;
C、在A~B之间增添盛有浓硫酸的洗气装置时能够吸收水蒸气,但是通过B装置后又会带进水蒸气,该选项不能提高测定准确度;
D、在C装置左侧导管末端增添多孔球泡,能够增大二氧化碳和氢氧化钙的接触面积,利于二氧化碳气体的全部吸收,该选项能提高测定准确度。
故选BC。
(3)设MgCO33H2O的质量为x,

![]()
x=13.8g
MgCO33H2O的纯度为:![]() ;
;
(4)将澄清石灰水换成Ba(OH)2溶液,其理由除了Ba(OH)2溶解度大,浓度大,使CO2被吸收的更完全外,还有BaCO3的相对分子质量比CaCO3大,等质量的MgCO33H2O生成的BaCO3质量大于CaCO3质量,实验时相对误差小。
(5)MgCO33H2O中镁元素、碳元素质量分数分别为:![]() ;
;
Mg5(OH)2(CO3)44H2O中镁元素、碳元素质量分数分别为:![]() ;
;
由计算可知,MgCO33H2O中的镁元素、碳元素质量分数都小于Mg5(OH)2(CO3)44H2O中的镁元素、碳元素质量分数,因此若获取MgCO33H2O的样品中含有少量Mg5(OH)2(CO3)44H2O,样品中MgCO33H2O的纯度偏大。


科目:初中化学 来源: 题型:
【题目】化学与我们生活密切相关。
(1)园丁定期给花草施用肥料硝酸钾,它所含有的营养元素是_____(填元素符号)
(2)既可用来治疗胃酸过多,也可用作为糕点“发酵粉”的物质是_____(写化学式)
(3)纯棉布与涤纶布的鉴别方法是_____。
(4)房屋装修后,可在室内放一些活性炭来吸收装修材料释放出的甲醛、苯等有毒气体,这是利用了活性炭的_____性质。
(5)蜂窝煤是一种常见燃料,如图所示。把煤做成蜂窝状的科学道理是_____。

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上合成清洁燃料乙醇,2CO+4H2 C2H5OH+X。下列说法错误的是
C2H5OH+X。下列说法错误的是
A. 反应前后分子数目变少B. 乙醇中C、H、O元素的质量比为12:3:8
C. X的化学式为H2OD. 将乙醇燃烧,只能生成水和二氧化碳
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两种固体物质(均不含结晶水)的溶解度曲线如图所示,下列说法错误的是( )

A. t1℃时,甲、乙的溶解度相等
B. t2℃时,甲的溶解度为50
C. 甲中混有少量的乙时,可用降温结晶的方法提纯甲
D. t1℃时,甲、乙两种饱和溶液恒温蒸发等质量的水,析出晶体的质量相等
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据所给实验装置图回答下列问题:
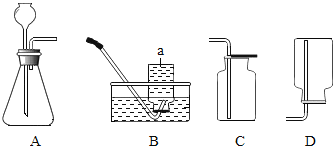
(1)图中仪器a的名称是_____;
(2)用A装置制氧气的化学方程式为_____;
(3)收集氧气可选用的一种装置是(填装置字母代码)_____,选择该装置的依据是_____;
(4)检验收集到的气体是氧气的方法是_____;
(5)用A装置还可以制二氧化碳,反应的化学方程式为_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】t1℃时,将等质量的硝酸钾和氣化钾分别加入到各盛有100g水的两个烧杯中,充分搅拌后现象如图1所示,硝酸钾和氣化钾的瑢解度曲线如图2所示。则下列说法正确的是
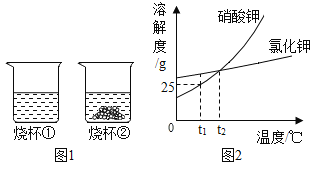
A.烧杯①的溶液一定是不饱和瑢液
B.烧杯①的溶液是硝酸钾溶液
C.烧杯②的溶液升温到t2℃时,烧杯底部还有部分物质不溶解
D.若烧杯①和烧杯②的溶液都升温到t2℃时,溶质的质量分数相等
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向含有MgCl2和HCl的混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,所加NaOH溶液质量与生成沉淀的质量关系如下图所示。下列说法中正确的是( )
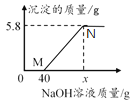
A. M点溶液中的溶质只有一种
B. 整个反应过程中,氯离子质量分数不变
C. 沉淀完全时,x的数值为80
D. N点溶液中氯化钠的质量为17.55g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某补钙剂的主要成分是碳酸钙。欲测定该补钙剂中碳酸钙的质量分数,某同学进行了如图所示的操作。实验前(即未装药品前)测得装置总质量为196.9g。(假设其它成分可溶于水但不参与反应)。
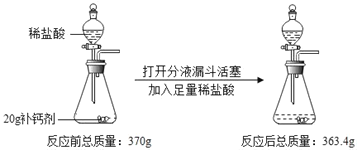
(1)补钙剂中碳酸钙的质量分数为_____。
(2)反应后所得溶液中溶质的质量分数_____。(写出计算过程,结果保留整数)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硫酸亚铁铵是一种重要的化工原料,用途十分广泛.硫酸亚铁铵俗称摩尔盐,下图为制取摩尔盐过程的示意图.

请回答下列问题:
(1)实验前,先用碳酸钠溶液浸泡废铁屑表面油渍.碳酸钠溶液可除去油渍是因为碳酸钠溶液的pH__7(填“>”、“<”或“=”).
(2)步骤②中,过滤操作,需要的玻璃仪器有烧杯、玻璃棒、__能用加热结晶的方法析出说明摩尔盐的溶解度__;
(3)废铁屑的主要成分是铁,同时含有少量氧化铁.请写出①中反应的化学方程式__;
(4)步骤②所得滤液中一定含有的溶质是__;
(5)能用酒精洗涤的原因__.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com