
【题目】“高质发展,后发先至”是连云港新一轮发展的主线,我市濒临黄海,拥有丰富的海洋资源。
(1)食用海鱼、海虾等海鲜可为人体提供的营养素主要是_____(填序号)
A 糖类 B 蛋白质 C 维生素 D 油脂
(2)从海水中获得粗盐的方法是采用蒸发结晶,而不是降温结晶,理由是_____;
(3)用氯化钠固体配制 100g 质量分数为 10%的氯化钠溶液。若测得所配制溶液的溶质质量分数偏小,其 原因可能是_____(填序号)。
A 氯化钠固体不纯 B 量取水时,俯视读数
C 溶解时,烧杯内壁有水 D 装瓶时,有少量溶液洒出
(4)某浓度的海水中主要离子的浓度如下:
离子 | Na+ | Mg2+ | Cl﹣ | SO 42﹣ |
浓度/g/L | 63.7 | 28.8 | 144.6 | 46.4 |
①从海水中提取 MgCl2,将 MgCl2 溶液在一定条件下蒸发结晶、熔融电解可制得金属镁,则 2L 该浓度的 海水理论上可得到金属镁的质量为_____g;
②将一定量的镁粉加入到适量硝酸亚铁和硝酸银的混合溶液中,充分反应后过滤,得到滤液和滤渣。取少 量滤液,加入稀盐酸溶液,无明显现象,则滤液中一定没有_____;取少量滤渣,加入足量稀盐酸, 有气泡产生,则滤渣中一定含有_____;
③净化水常用的方法有沉降、过滤、吸附和蒸馏,活性炭在净水器中能起到过滤和吸附的作用,这是由于 活性炭具有_____结构。
④电解水实验揭示了水的组成(如下图)。
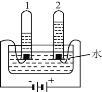
电解水的反应方程式为__________________, 实验过程中可加入稀硫酸以增强导电性,实验结束后,溶液 pH 将_______(填“增大”、 “减小”或“不变”)。
(5)常温下,氯酸钾的溶解度较小,在工业上可通过如下转化制得。
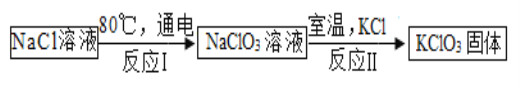
①实验室用氯酸钾制取氧气的化学方程式为_____ ;
②反应Ⅰ中,是将_____能转化成化学能;
③反应Ⅱ的基本反应类型为复分解反应,请写出反应方程式_____;
④该工业转化中可以循环利用的物质是_____ 。
【答案】B 氯化钠的溶解度受温度变化影响较小 AC 57.6 硝酸银 铁 疏松多孔 2H2O![]() 2H2↑+O2↑ 减少
2H2↑+O2↑ 减少 ![]() 电
电 ![]() 氯化钠
氯化钠
【解析】
(1)食用海鱼、海虾等海鲜可为人体提供的营养素主要是蛋白质,故选B;
(2)氯化钠的溶解度受温度变化影响较小,所以从海水中获得粗盐的方法是采用蒸发结晶,而不是降温结晶;
(3)测得所配制溶液的溶质质量分数偏小,可能是溶质质量偏小或溶剂质量偏大。
A 氯化钠固体不纯,氯化钠的实际质量偏小,导致所配制溶液的溶质质量分数偏小,故A正确;
B 量取水时,俯视读数,水的实际体积偏小,导致所配制溶液的溶质质量分数偏大,故B错误;
C 溶解时,烧杯内壁有水,导致所配制溶液的溶质质量分数偏小,故C正确;
D 溶液具有均一性。装瓶时,有少量溶液洒出,不会影响氯化钠的质量分数,故D错误。故选AC;
(4)①依据镁元素守恒可知,每升海水中含有镁离子的质量是28.8g,所以2L该浓度的海水理论上可得到金属镁的质量为57.6g;
②将一定量的镁粉加入到适量硝酸亚铁和硝酸银的混合溶液中,镁会先与硝酸银反应,再与硝酸亚铁反应,所以取少量滤液,加入稀盐酸溶液,无明显现象,则滤液中一定没有硝酸银;取少量滤渣,加入足量稀盐酸,有气泡产生,则滤渣中一定含有铁;
③活性炭具有疏松多孔的结构,具有吸附性;
④水在通电的条件下生成氢气和氧气,化学方程式为:2H2O![]() 2H2↑+O2↑,水的质量减小,稀硫酸的浓度增大,所以溶液pH将减小;
2H2↑+O2↑,水的质量减小,稀硫酸的浓度增大,所以溶液pH将减小;
(5)①氯酸钾在二氧化锰的催化作用下在加热条件下生成氯化钾和氧气,![]() ;
;
②反应Ⅰ中,是将电能转化成化学能;
③反应Ⅱ,即氯酸钠溶液与氯化钾反应生成氯酸钾固体和氯化钠,化学方程式为:NaClO3+KCl═KClO3↓+NaCl;
④氯化钠在反应过程中,既是反应物,也是生成物,该转化中可以循环利用的物质是氯化钠(NaCl)。


科目:初中化学 来源: 题型:
【题目】正确的实验操作是学习化学和实验探究的基础和保证。下列图示实验操作中,正确的是( )
A.  闻药品气味
闻药品气味
B.  液体的取用
液体的取用
C. ![]() 读出液体体积
读出液体体积
D. 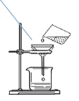 过滤
过滤
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室开放日,某化学兴趣小组的同学在老师的指导下,设计了如下实验装置进行气体制取的探究,回答问题:

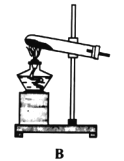

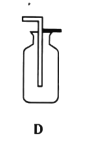
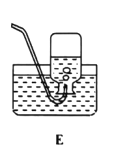
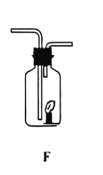
(1)实验室用氯酸钾制取氧气的发生装置是_____(填序号),该反应的化学方程式为_____.
(2)选择气体收集方法时,必须考虑的气体性质有_____(填序号)。
①颜色 ②密度 ③溶解性 ④可燃性
(3)某同学连接A、F进行实验,A中所加药品不同。
①若实验时F中蜡烛火焰熄灭,则A中反应的化学方程式为_____
②若实验时F中蜡烛燃烧更旺,则A中反应的化学方程式为_____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某气体可能由初中化学中常见的一种或多种气体组成,经测定其中只含有碳、氧两种元素,质量比为1:2,则关于该气体的正确说法是( )
A. 一定是纯净物
B. 一定是CO和CO2的混合物
C. 该气体最多的可能组成的2种
D. 该气体最多的可能组成有3种
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】右下图是甲、乙、丙三种固体物质的溶解度曲线,下列说法错误的是
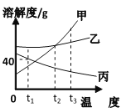
A. t1℃时,丙的溶解度为 40g
B. 甲的溶解度随温度的升高而增大
C. t2℃时,甲、乙两种物质的饱和溶液中溶质的质量一定相等
D. 分别将 t3℃时,甲、乙、丙的饱和溶液降温至 t1℃,则所得的三种溶液中溶质的质量分数大小关系是乙>甲>丙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】价态图是学习元素化合物的方法,图中字母代表含硫元素的物质,请书写下列化学用语。

(1)物质a的化学式__________
(2)物质b的两个分子_________
(3)物质h(若为钠盐)中硫元素的化合价____________
(4)物质f的两个酸根离子_________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】分子筛(又称为沸石,主要成分为水和硅铝酸钠)可作为催化剂或吸附剂等,以高岭土[主要成分为Al2(Si2O5](OH)4]。烧碱等为主要原料生产分子筛的工艺流程如下:
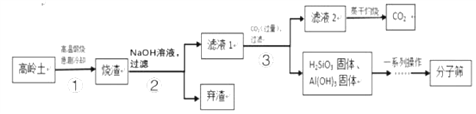
(1)步骤①所得烧渣中主要含有两种固体氧化物,分别为SiO2和_____(写化学式)
(2)步骤②加入NaOH溶液前需将烧渣粉碎,其目的是________________________。
(3)步骤③发生的反应之一是Na2SiO3溶液和通入的CO2气体生成偏硅酸(H2SiO3)沉淀和碳酸氢钠,该反应的化学方程式为___________________。
(4)上述流程中可以循环利用的物质(水除外)是_____________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】海洋中蕴含着丰富的资源,人们可以从海水中获取很多物质。
(1)海水淡化是解决淡水资源不足的重要方法。下列方法中,可以使海水淡化的是_____ (填字母序号)。
A 过滤法 B 沉淀法 C 多级闪急蒸馏法 D 分解法
(2)海水蒸发结晶可制得粗盐。晒制粗盐的主要成分为NaCl,还含有少量的MgCl2;、CaCl2、MgSO4、泥沙等杂质。下面是由粗盐获取较纯净精盐的一种方法:
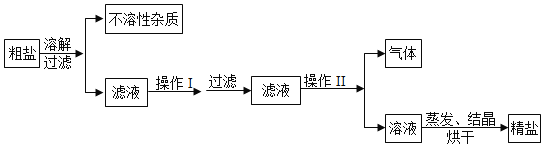
①为除去MgCl2、CaCl2、MgSO4可溶性杂质,操作I中依次加入的物质(过量)和顺序,合理的是_____;
a NaOH、BaCl2、Na2CO3; b Ba(NO3)2、Na2CO3、NaOH
c Na2CO3、BaCl2、NaOH d BaCl2、NaOH、Na2CO3
②操作I过量加入各物质的目的是_____;
③操作Ⅱ加入适量的盐酸,作用是_____。
④假设除杂过程中氯化钠没有损失,则理论上除杂后获得食盐的质量_____除杂前食盐的质量(填“>”“<”或“=”)
(3)利用海水制取纯碱和金属镁的流程如图所示,试回答问题:
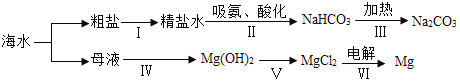
①在步骤Ⅱ中通入氨气的作用是_____,请写出步骤ⅲ中发生反应的化学方程式_____。
②提取氯化镁经历ⅳ、ⅴ两步转换的目的是_____。写出步骤ⅳ中发生反应的化学方程式_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请根据下列实验装置图回答问题:
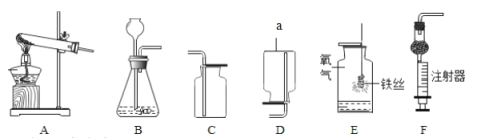
(1)仪器a的名称是_____
(2)实验室用过氧化氢和二氧化锰制取氧气,选用的发生装置是_____(填字母序号),其中二氧化锰的作用为_____。装置E中,铁丝与氧气反应的化学方程式为_____。
(3)实验室制取二氧化碳的化学方程式为_____;选用的收集装置是_____(填字母序号)。制取二氧化碳时,用装置F替代装置B的优点是_____。
(4)氨气是一种无色、有强烈刺激性臭味的气体,极易溶于水,水溶液呈碱性。实验室常用加热氯化铵和熟石灰两种固体混合物来制取氨气。某兴趣小组的同学设计如图G~J所示装置对氨气的制取、性质进行探究。
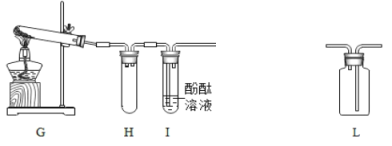
①写出G装置制取氨气的化学方程式_____;
②装置H的作用是_____;
③用L装置收集氨气,应从_____(长或短)导管进。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com