
 人类的生产生活离不开金属材料,随着科技水平的不断提高,金属及其合金在日常生活中扮演着越来越重要的角色.
人类的生产生活离不开金属材料,随着科技水平的不断提高,金属及其合金在日常生活中扮演着越来越重要的角色.分析 (1)根据铁生锈的条件分析回答;
(2)根据炼铁的原理写出反应的方程式;
(3)根据金属活动性顺序进行分析;
(4)根据材料的分类、灭火的原理以及质量守恒定律来分析;
(5)①根据氢气的质量求出硫酸中溶质的质量,从而求出废液中硫酸的质量分数即可;
②根据铁钉的铁锈未除净,则铁锈消耗一部分硫酸进行解答.
解答 解(1)汽车车体多用钢材制造.表面喷漆不仅美观,而且可有效防止与空气、水接触而生锈.
故填:水和氧气;
(2)工业上用CO还原赤铁矿冶炼金属铁的化学方程为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
故填:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(3)在金属活动性顺序中,排在氢前面的金属会与酸反应生成氢气,所以在实验室中探究铝、铜的金属活动性顺序,除铝、铜外,还需要用到的试剂是稀盐酸或稀硫酸或可溶铜盐溶液或可溶铝盐溶液.
故填:稀盐酸或稀硫酸或硫酸铜溶液;
(4)①塑料属于有机合成材料,玻璃属于无机非金属材料;铸铁属于金属材料;
故填:塑料;
②油着火可用锅盖盖灭,其原理是使可燃物--油隔绝氧气;
故填:使油与氧气隔绝;
③由于铜锈的主要成分是碱式碳酸铜(Cu2(OH)2CO3).含有铜、碳、氧、氢元素,所以,铜生锈除了与空气中的氧气、水有关外,还需要与空气中含有碳元素的物质有关,此物质是二氧化碳;
故填:二氧化碳;
(5)设与铁反应的硫酸的质量为x,
烧杯中稀硫酸废液的质量为:33.2g-18.2g=15.0g;
Fe+H2SO4═FeSO4+H2↑
98 2
x 0.1g
则$\frac{98}{2}$=$\frac{x}{0.1g}$
解得x=4.9g
该废液中硫酸的质量分数为:$\frac{4.9g}{15.0g}$×100%=32.7%
答:废液中硫酸的质量分数是32.7%.
③如果铁钉的铁锈未除净,则铁锈消耗一部分硫酸,氧化铁和硫酸反应生成硫酸铁和水;根据氢气求出的硫酸质量就偏小,从而使计算出的硫酸的质量分数偏小.
故答案为:偏小.
点评 本题考查了常见金属的应用以及金属活动性顺序的判断,方程式的相关计算,细心分析解答.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:解答题
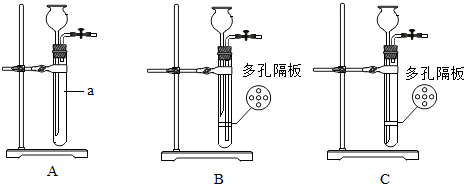
 杂质不溶于水且不参加反应):
杂质不溶于水且不参加反应):| 实验操作 | 实验现象 | 结论 | |
| 甲 | 取样于试管中,滴加紫色石蕊试液 | 试液变红 | 有盐酸 |
| 乙 | 取样于试管中,逐滴滴加碳酸钠溶液至过量 | 有气泡冒出 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
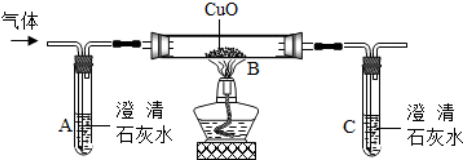
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 食醋与纯碱混合产生大量的气泡 | |
| B. | 鸡蛋清倒入开水中产生黄色固体 | |
| C. | 光亮的铜片在火焰上灼烧表面变黑 | |
| D. | 铁钉在潮湿的空气中生成红棕色铁锈 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
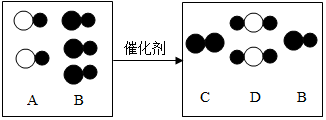
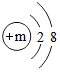 ,其微粒符号可表示为X2,则m的值为8.
,其微粒符号可表示为X2,则m的值为8.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
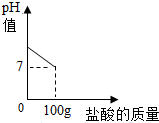 在含氯化钠杂质的纯碱样品12.4g中逐渐加入质量分数为7.3%稀盐酸,所加稀盐酸的质量与溶液的pH值的关系如图所示,计算:
在含氯化钠杂质的纯碱样品12.4g中逐渐加入质量分数为7.3%稀盐酸,所加稀盐酸的质量与溶液的pH值的关系如图所示,计算:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 分子是保持物质性质的一种粒子 | |
| B. | 物体有热胀冷缩现象,主要是因为物体中的粒子大小随温度的改变而改变 | |
| C. | 分子、原子、离子都可以直接构成物质 | |
| D. | 具有相同质子数的微粒一定属于同种元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com