
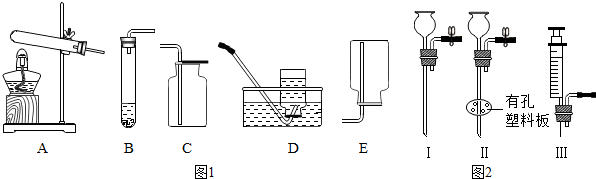
分析 制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集.实验室是用锌粒和稀硫酸在常温下反应制氢气的,氢气难溶于水,密度比空气的密度小,因此可以用排水法和向下排空气法收集;组合后的装置与B相比的优点是:随时控制反应的发生和停止.
解答 解:(1)实验室是用锌粒和稀硫酸在常温下反应制氢气的,氢气难溶于水,密度比空气的密度小,因此可以用排水法和向下排空气法收集;如果用双氧水和二氧化锰制氧气就不需要加热,过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,要注意配平;氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集;故答案为:Zn+H2SO4=ZnSO4+H2↑或2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(2)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;组合后的装置与B相比的优点是:随时控制反应的发生和停止;故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑;随时控制反应的发生和停止;
点评 本考点主要考查了气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和注意事项等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 |
| I 取少量黑色产物加入到装有足量FeCl3溶液的烧杯中,充分反应后过滤,对过滤所得固体用蒸馏水洗涤. | 黑色固体部分溶解 | 猜想2和4不成立 |
| Ⅱ取少量操作Ⅰ所得滤渣于试管,再加入足量的稀盐酸,充分反应后,再加入适量KSCN溶液 | 黑色固体全部溶解,溶液不变红色. | |
| Ⅲ另取少量黑色产物装入玻璃管中,通入CO,一段时间后加热,并将反应后的气体通入装有一定的澄清石灰水烧杯中. | 澄清石灰水变浑浊 | 猜想1不成立,猜想3成立. |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 图为某高钙片标签上的部分文字,请仔细阅读后回答下列问题.
图为某高钙片标签上的部分文字,请仔细阅读后回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com