
【题目】在点燃的条件下,3.9g苯(C6H6)与9.6gO2恰好完全反应,生成6.6gCO2、2.7gH2O 和物质X。则X的质量为__________g;该反应的化学方程式为_________。
【答案】4.2 2C6H6+6O2![]() 3CO2+3H2O+3CO
3CO2+3H2O+3CO
【解析】
根据质量守恒定律,反应前后质量总和不变,则有:9.6g+3.9g=6.6g+2.7g+X,解得X=4.2g;
3.9g苯中碳元素的质量=![]() ,氢元素的质量=3.9g-3.6g=0.3g;6.6gCO2中碳元素的质量=
,氢元素的质量=3.9g-3.6g=0.3g;6.6gCO2中碳元素的质量=![]() ,氧元素的质量=6.6g-1.8g=4.8g;2.7gH2O中氢元素的质量=
,氧元素的质量=6.6g-1.8g=4.8g;2.7gH2O中氢元素的质量=![]() ,氧元素的质量=2.7g-0.3g=2.4g, 反应前的氢元素质量=反应后的氢元素质量=0.3g,根据质量守恒定律,X中不含有氢元素;X中存在碳元素的质量=3.6g-1.8g=1.8g;X中存在氧元素的质量=9.6g-4.8g-2.4g=2.4g;X中碳原子与氧原子的个数比=
,氧元素的质量=2.7g-0.3g=2.4g, 反应前的氢元素质量=反应后的氢元素质量=0.3g,根据质量守恒定律,X中不含有氢元素;X中存在碳元素的质量=3.6g-1.8g=1.8g;X中存在氧元素的质量=9.6g-4.8g-2.4g=2.4g;X中碳原子与氧原子的个数比=![]() ,所以X为一氧化碳。苯、氧气、二氧化碳、水、一氧化碳的分子个数比为
,所以X为一氧化碳。苯、氧气、二氧化碳、水、一氧化碳的分子个数比为![]() =2:6:3:3:3,所以将苯燃烧的化学方程式为:2C6H6+6O2
=2:6:3:3:3,所以将苯燃烧的化学方程式为:2C6H6+6O2![]() 3CO2+3H2O+3CO。
3CO2+3H2O+3CO。


科目:初中化学 来源: 题型:
【题目】某研究小组发现,将适量淀粉放人过氧化氢溶液中,过氧化氢溶液的分解速率加快。对于此现象,该小组同学进行了如下探究
[提出问题]淀粉能否作过氧化氢分解的催化剂?
[作出猜想]淀粉能作过氧化氢分解的催化剂。
[实验验证]
实验编号 | 实验操作 | 实验现象 |
① | 向试管中加入过氧化氢溶液,再将带火星的小木条伸入试管中 | 小木条不复燃 |
② | 向盛有过氧化氢溶液的试管中加入0.5g淀粉,再将带火星的小木条伸入试管中 | 产生大量气泡,小木条复燃 |
③ | 将②中反应结束,将试管中的剩余物质过滤、洗涤、干燥、称量 | 得固体物质0.5g |
④ | 将③中所得固体放放试管中,重新加入过氧化氢溶液,然后将带火星的小木条伸入试管中 | 产生大量气泡,小木条复燃 |
[分析数据、得出结论]
(1)实验③④证明淀粉的________和________在反应前后均未发生变化。可作过氧化氢分解的催化剂。
(2)写出淀粉催化过氧化氢分解的文字表达式____________
[实验拓展]
该小组设计了下图所示装置对比淀粉与二氧化锰的催化效果,实验均以生成25mL气体为准,其他可能的影响因素忽略不计,相关教据见下表:

实验编号 | 3%过氧化氢溶液的体积 | 其他物质质量 | 待测数据 |
I | 20mL | 淀粉0.5g | a |
II | 20mL | 二氧化锰0.5g | b |
(1)上述实验中的“待测数据”是指_______;最后结果表明二氧化锰的催化效果较好,则a___b(填“<”、“>”或“=”)。
附加分:若正确回答下列小题,将获得4分的奖励,但化学试卷总分不超过60分。
(2)小明用坩埚钳夹取少量光亮的铜丝,放在酒精灯火焰上灼烧至表面变黑后,迅速插入一只装有20mL3%过氧化氢溶液的试管中,观察到试管内迅速产生大量气泡。且变黑的铜丝质量和化学性质不发生改变,于是得出结论:氧化铜可以加快过氧化氢分解。
有同学认为这个结论不可靠,原因是过氧化氢分解速率加快还可能与_______有关。请你设计实验方案证明__________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阅读下面科普短文(原文作者:王龙飞等,有删改)。
纯净的臭氧在常温下是天蓝色的气体,有难闻的鱼腥臭味,不稳定,易转化为氧气。它虽然是空气质量播报中提及的大气污染物,但臭氧层中的臭氧能吸收紫外线,保护地面生物不受伤害。而且近年来臭氧的应用发展较快,很受人们的重视。
生产中大量使用的臭氧通常由以下方法制得。

臭氧处理饮用水。早在19世纪中期的欧洲,臭氧已被用于饮用水处理。由于臭氧有强氧化性,可以与水中的有害化合物(如硫化铅)发生反应,处理效果好,不会产生异味。
臭氧做漂白剂。许多有机色素的分子遇臭氧后会被破坏,成为无色物质。因此,臭氧可作为漂白剂,用来漂白麻、棉、纸张等。实践证明,臭氧的漂白作用是氯气的15倍之多。
臭氧用于医用消毒。与传统的消毒剂氯气相比,臭氧有许多优点,如表1所示。
表1 臭氧和氯气的消毒情况对比
消毒效果 | 消毒所需时间(0.2mg/L) | 二次污染 | 投资成本 (900m3设备) | |
臭氧 | 可杀灭一切微生物,包括细菌、病毒、芽孢等 | <5min | 臭氧很快转化为氧气,无二次污染,高效环保 | 约45万元 |
氯气 | 能杀灭除芽孢以外的大多数微生物,对病毒作用弱 | >30min | 刺激皮肤,有难闻气味,对人体有害,有二次污染、残留,用后需大量水冲洗 | 约3~4万元 |
依据文章内容回答下列问题。
(1)已知一个臭氧分子由三个氧原子构成,臭氧的化学式为___________。
(2)臭氧处理饮用水时,利用了臭氧的___________(填“物理”或“化学”)性质。
(3)臭氧转化为氧气的微观示意图如下,请在方框中补全相应微粒的图示。_________

(4)臭氧与氯气相比,消毒速度更快的是___________。
(5)下列关于臭氧的说法中,正确的是___________。
A. 臭氧的漂白作用比氯气强
B. 由氧气制得臭氧的过程中,既有物理变化也有化学变化
C. 臭氧在生产生活中有很多用途,对人类有益无害
D. 臭氧稳定性差,不利于储存,其应用可能会受到限制
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知A物质常温下是液体,在一定条件下,可以分解生成B和C两种气体,而B和C点燃又会生成A,将D物质放在B中燃烧,会发出蓝紫色火焰,同时生成有刺激性气味的气体E.常温下F物质在G催化作用下产生A和B,且G为黑色粉末.试回答:
(1)写出下列物质的名称:
A:__________ D:___________ E:_________
(2)写出常温下F物质在G催化作用下产生A和B的文字表达式: ______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在实验室常用加热高锰酸钾或分解过氧化氢的方法制取氧气,回答下列问题:
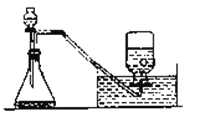
(1)写出在MnO2的催化条件下用过氧化氢制氧气的化学方程式_____________。
(2)图中收集氧气的方法叫_____ ,另外还可用______法,可以用此方法收集的依据是________。
(3)该方法收集的氧气验满的方法是___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在高温条件下,A、B两种物质可以发生化学反应生成C和D.反应前后分子种类变化的微观示意图如图所示.在这个化学反应中,以下叙述正确的是( )

A. 该反应是化合反应
B. 物质B的相对分子质量是16
C. 生成C和D的微粒个数比1:1
D. 生成C和D的质量比是14:3
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示,装置A、B的燃烧匙中分别装红磷和硫粉,集气瓶A和B中原来均集满了氧气,C中盛有水,X为止水夹.分别点燃红磷和硫粉,使之在A、B两瓶中充分燃烧(红磷和硫粉均为足量,X关闭着)。当反应完成并冷却至室温后打开止水夹,看到的现象是( )
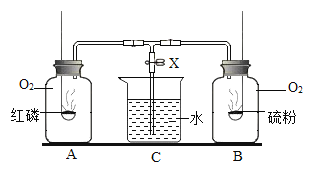
A. 水流进A瓶 B. 水流进B瓶
C. 水流进A、B瓶 D. 水既不流进A也不流进B瓶
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)运用所学化学知识完成下列填空题:
①铝表面形成致密氧化膜的化学式_________________________;
② ![]() 中“+2”表示________
中“+2”表示________
(2)叠氮化钠(NaN3)被广泛应用于汽车安全气囊。叠氮化钠的制备:将金属钠与液态氨反应得NaNH2,再将NaNH2与N2O反应可生成NaN3,该反应的化学方程式为:
2NaNH2 + N2O=NaN3 + NaOH + X。请回答下列问题:
①N2O的名称是________,X的化学式为_______________;
②NaNH2中氮元素的化合价为____________,其中H、N、Na元素的质量比为____________
③NaN3中的阳离子为_________。
(3)为减少汽车尾气排放,我国将在全国范围内推广车用乙醇汽油。

①汽油不完全燃烧会产生CO和碳氢化合物,乙醇(C2H5OH)的燃烧比汽油更充分,乙醇完全燃烧的化学方程式为__________。
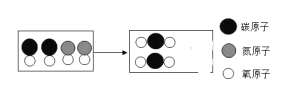
②汽车尾气中含有CO、NO等污染物,使用三元催化剂可以将它们转化成CO2和N2,其微观示意图如下图所示,请在方框中补全相应微粒的图示。_____
(4)某同学用如图所示装置研究质量守恒定律的相关问题。反应前称得总质量为m1,将足量稀硫酸全部倒入烧杯,充分反应后,称得总质量为m2。
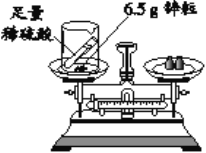
①m1≠m2的原因是_________ (用化学方程式表示)。该反应是否遵守质量守恒定律_________(填“是”或“否”)。
②理论上m1和m2的差值是_________ g。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学与文学有着不解之缘,很多成语和文学作品中都蕴含着化学知识,请回答下列问题:
(1)“遥知不是雪,唯有暗香来”说明分子具有的性质是_____.
(2)“砖木取火”说明燃烧需要的条件之一是_____.
(3)“真金不怕火”说明金的化学性质是_____.(选填“活泼”或“稳定”)
(4)在古代人们把烧红的生铁放在铁砧上反复捶打最终使生铁转化为钢,这就是“百炼成钢”的来历,这样做的目的是使生铁中的碳的燃烧,从而降低碳元素的含量,请写出上述过程中最关键反应的化学方程式_____________.
(5)我国是最早采用湿法冶铜的国家,文献记载“胆铜法”:用铁与“胆水”(含CuSO4)反应获得铜,写出反应的化学方程式:__________;该化学反应基本的类型是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com