
����Ŀ��ʵ���ҳ������������ķ�ˮ���ٶ���ˮ��ֻ�������ᣩ���辭���������ԣ�ij��ȤС��ͬѧ����һ����������������������Һ���������Է�ˮ��
��1�����Լ���ˮ������ˮ�����Եķ�����_____��
��2������200g��������Ϊ4%������������Һ��
������m��NaOH����_____g��V��H2O��_____mL��ˮ���ܶȽ���Ϊ1.0gmL��1����
����ȡ�������ƣ�����������ƽƽ���һֻ�ձ�����������ƽ�����̣�����������Ȼ��_____���������Ⱥ�˳������ĸ����ֱ����ƽƽ�⡣
A ���ձ��м��������ƹ���
B ����Ҫ�������롢�ƶ�����
����ȡˮ�����ܽ⣻��ת�ơ�
��3����������ˮ������������Һ�����ᷢ����Ӧ����û��ʵ��������ȤС��ͬѧ�������ͼ��ʾʵ�飺
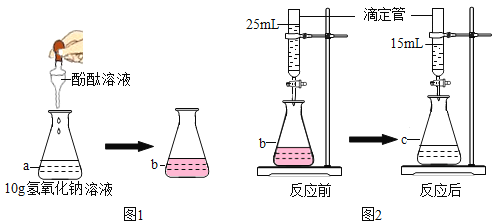
����ƿ�м���10g������2�������Ƶ�����������Һ�����뼸�η�̪��Һ���õζ��ܣ��ζ���Ϊһϸ���Ĺ�״������һ�˾��л�˨���أ����Ͼ��п̶�ָʾ���ȣ����������ˮ��������������Һ��ɫǡ�ñ�Ϊ��ɫΪֹ����ش�
����̪��Һ��������_____��
���ߵμӷ�ˮ���߲�����Ŀ����_____��
�����ζ����з�ˮ����Ϊ20mLʱ����ƿ��Һ��һ�����ڵ���������_____�������ӷ��ţ���
����b����Һ��ɫǡ�ñ�Ϊ��ɫʱ������ȥ�˷�ˮ10mL������ȤС����������Է�ˮ���������������������Ҫ�õ����������⣬����Ϊ����Ҫ��������_____��
��4����ȤС��ͬѧ�ڵμӷ�ˮһ��ʱ�������Һ�����������ݲ�������һ���쳣�����������ǵ�̽�����������Ŀ���ԭ����_____�����û�ѧ����ʽ��ʾ����ʵ�ԭ��_____����Ҫ��ȥ��Һ�б������ɵ����ʣ����Ҫд�����ʵ�鷽����_____��
���𰸡�ȡ������Һ���Թ��У��μ�ʯ����Һ��ʯ����Һ���ɫ��˵����Һ������ 8 192 B��A �ж��Ƿ�ǡ����ȫ��Ӧ ʹ��Ӧ���ַ�Ӧ Na+ ��ˮ�ܶ� �������ƺͶ�����̼��Ӧ������̼���ƺ�ˮ 2NaOH+CO2�TNa2CO3+H2O ���ˮ�м�������������Һ��ֱ������������ʱΪֹ������
��������
����������Һ�Լ��ԣ���ʹ��̪��Һ���ɫ���ܺͶ�����̼��Ӧ����̼���ƺ�ˮ���ܺ�ϡ���ᷴӦ���������ƺ�ˮ��
̼���ƺ��������Ʒ�Ӧ����̼��Ƴ������������ơ�
��1������ˮ�����Եķ����ǣ�ȡ������Һ���Թ��У��μ�ʯ����Һ��ʯ����Һ���ɫ��˵����Һ�����ԣ�
��2���ټ���m��NaOH����200g��4%��8g��V��H2O����200g��8g����1.0gmL��1��192mL��
�ڳ�ȡ�������ƣ�����������ƽƽ���һֻ�ձ�����������ƽ�����̣�����������Ȼ����Ҫ�������롢�ƶ����룬���ձ��м��������ƹ��壬ֱ����ƽƽ�⣻
��3���ٷ�̪��Һ���������ж��Ƿ�ǡ����ȫ��Ӧ����ǡ����ȫ��Ӧʱ��Һ�ɺ�ɫ�����ɫ��
�ڱߵμӷ�ˮ���߲�����Ŀ����ʹ��Ӧ���ַ�Ӧ��ʵ������ȷ��
�۵��ζ����з�ˮ����Ϊ20mLʱ������������ȫ��Ӧ�����ж�ϡ�����Ƿ�ǡ����ȫ��Ӧ�������ƿ��Һ��һ�����ڵ���������Na+��
�ܵ�b����Һ��ɫǡ�ñ�Ϊ��ɫʱ������ȥ�˷�ˮ10mL������ȤС����������Է�ˮ���������������������Ҫ�õ����������⣬����Ϊ����Ҫ�������Ƿ�ˮ�ܶȣ�������Ϊ���ݷ�ˮ�ܶȺ�������Լ����ˮ���������ݷ�Ӧ�Ļ�ѧ����ʽ�����������Ƶ��������Լ���������������һ�����Լ������Է�ˮ�����������������
��4����ȤС��ͬѧ�ڵμӷ�ˮһ��ʱ�������Һ�����������ݲ��������Ŀ���ԭ���ǣ��������ƺͶ�����̼��Ӧ������̼���ƺ�ˮ����Ӧ�Ļ�ѧ����ʽ��2NaOH+CO2�TNa2CO3+H2O��
��Ҫ��ȥ��Һ�б������ɵ����ʣ�ʵ�鷽�������ˮ�м�������������Һ��ֱ������������ʱΪֹ�����˵õ�����������Һ��


 ���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д�
���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д� ����ѵ��ϵ�д�
����ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��С����������ʴ��������̽��������ʱ����������Ʒ����ֽ���ô�ͷ��̶��������ϣ�Ѹ��������װ����ͼ���۲쵽��Ͳ��ˮ�ص�������������ƿ(���ݻ�Ϊ146 mL)�����¶Ȼָ������£�����Ͳ��ˮ��߶Ȳ���ʱ����(��ʱƿ��������������Ϊ��)����¼��ʼ��������Ͳ�Ķ����Լ�����ʱ�����
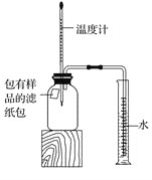
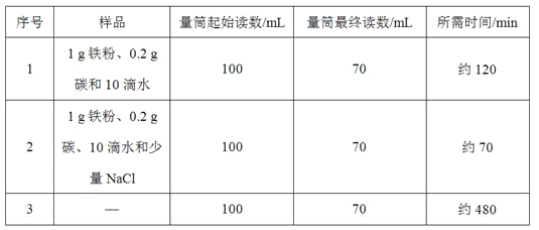
(1)ʵ��ٺ͢�˵��NaCl����____����ʴ�����ʡ�
(2)ʵ�鿪ʼ���ƿ���¶�����������˵��������ʴ������____(��������������������)���̡�
(3)ʵ�������ȡ����ֽ�����۲쵽�к���ɫ�������ɣ������ʵĻ�ѧʽ��______��
(4)��֪̼�ܹ��ӿ����������ٶȣ�С����ͨ��ʵ��ٺ͢���̽��̼������ʴ���ʵ�Ӱ�죬���ڱ���հ״���дʵ��۵���Ʒ���___��
(5)��װ�û������ڲ��������������ĺ����������������ݼ������������������___(С�������1λ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС���ͬѧ��̽���������й�����ʱ����������ͼ��ʾʵ�飺��Aʵ���������֧�Թ��ڵ����ʵ���һ�ྻ�ձ��У�һ��ʱ�����ˡ�Ϊȷ�����˺�õ�����������Һ�ijɷ֣�ͬѧ�ǽ���������ʵ�顣

ʵ��һ�������ijɷ���ʲô��
��1����ͬѧȡ�����������Թ��У�����ϡ���ᣬ�����ݲ�����֤�������ﲻ��_____����ͬѧͨ����������Ҳ�õ���ͬ���Ľ��ۣ����������������_____��
ʵ�������Һ�����������Щ��
��2��ͬѧ����Ϊһ��������������Ϊȷ�����ܺ��е��������ʣ�ͬѧ�ǽ���������ʵ�飺
ʵ�鲽�� | ʵ������ | ʵ����� |
ȡ������Һ�������м����������� | _____ | ��Һ������ʻ������������ͭ |
��д����������ͭ��Ӧ�Ļ�ѧ����ʽ��_____��
��3����ͬѧ�������ֱ�ӹ۲���Һ����ɫ�ж���Һ���Ƿ�������ͭ��ͬѧ�Ƕ�����ͭ��ҺΪʲô����ɫ�ܸ���Ȥ������̽������ͭ��Һ����������ʹ��Һ����ɫ����Ƶ�ʵ�鷽�����£�
ʵ����� | ʵ������ | ʵ����� |
��ȡ����_____��Һ���۲���ɫ | ��Һ����ɫ | ��������Ӳ���ʹ��Һ����ɫ |
��ȡ��������ͭ��Һ���۲���ɫ | ��Һ����ɫ | ͭ����ʹ��Һ����ɫ |
��4�����ˣ�3����ʵ�鷽���⣬�㻹�������������̽������ͭ��Һ�е�������������ʹ��Һ����ɫ��ʵ�������ҩƷ��������ѡ�������ʵ�������ʵ������
ʵ������ | ʵ������ |
_____ | _____ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ�����⡢������Ԫ����ɵĻ������һ�����ǿ�ѧ�����ڴ���ʵ��Ļ����ϵó��ġ�
(1)ʵ�����г��ö������̺�˫��ˮ��Ӧ���Ʊ������������ͼ1��װ����ѡ����װһ����ȡ����������װ�ã���ȷ������˳��Ϊ___(�ýӿڴ���ĸ��д)��
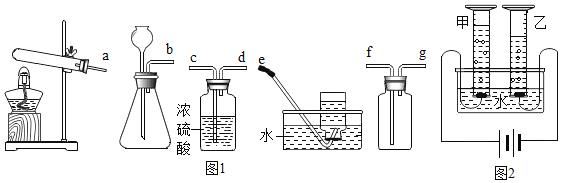
(2)�о�������ȼ��ʵ����������ʶˮ��ɵĿ�ʼ��
�������ڵ�ȼǰһ��Ҫ___��
�������ڿ�����ȼ��ʱ�����ڻ����Ϸ���һ��������С�ձ����ɹ۲쵽��������___������ͬ�����£���ʹ1L������ȫȼ�գ������������ԼΪ___L��
(3)��ѧ������������ⷨ��֤����ˮ�����(װ����ͼ2��ʾ���缫����ˮ�����ɵ����巴Ӧ)�����ʱ��ˮ�������������NaOH����������__��ͨ��һ��ʱ����ּס������������ռ��������������С��1��2����ԭ�������__(д��һ������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C���ֹ������ʵ��ܽ��������ͼ��ʾ���ش��������⣺
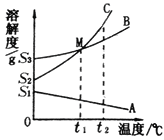
(1)ͼ��M���������_____��
(2)��0��ʱ����B��l00g������Һ������l0gˮ���ٻָ���0�棬ʣ����Һ������Ϊ_____g��
(3)��0��ʱ����C�ı�����Һ������t2��(�ܼ�����)����ʱ������Һ��������������Ϊ_____��
(4)��֪C��һ�ְ�ɫ���壬Ҫʹһ�������͵�C��Һ��ɱ�����Һ���ɲ�ȡ��һ�ַ�����_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1kg��ͬȼ��ȼ�ղ���CO2��SO2�����������ʾ��
ȼ�� | ȼ�ղ�������/g | |
CO2 | SO2 | |
���� | 2900 | 5.0 |
��Ȼ�� | 2500 | 0.1 |
ú | 2500 | 11.0 |
�����н�����ȼ����______��ʹ��______��ȼ��ʱ�����γ����ꡣ
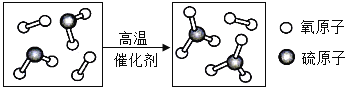
�������γɹ�����ijһ����Ӧ����ʾ��ͼ����ͼ��ʾ����÷�Ӧ�Ļ�ѧ����ʽΪ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ľ�Ǵ���һ��������������Ʒ��������൱�����ǡ���ͼ��ľ�Ǵ������ǵ��ܽ������
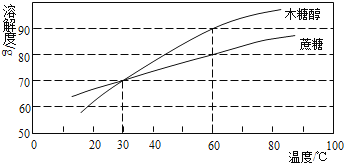
��1��20��ʱ��ľ�Ǵ����ܽ�ȣ�����ڡ����ڡ�С�ڣ�_____���ǵ��ܽ�ȡ�
��2��40��ʱ��100gˮ�м���60gľ�Ǵ�������ܽ��������ҺΪ_____����ͻ��ͣ���Һ��
��3��Ҫʹ�ӽ����͵�ľ�Ǵ���Һ��ɱ�����Һ�����Բ��õĴ�ʩ�ǣ�_____��_____
��4������60��ʱľ�Ǵ����������ֱ�����Һ����ʹ���ǵ�����������ȣ�����Ϊ������Һ���ɲ�ȡ�ķ����ǣ�д��һ�ּ��ɣ�_____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ1���Ȼ��ƺ�����ص��ܽ�����ߡ��������ش����⡣
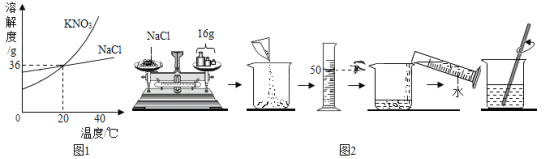
��1��Ӱ����������ܽ�ȵ��������¶Ⱥ�_________________��
��2��60��ʱ���Ӻ�������NaCl�ı���KNO3��Һ�еõ�KNO3�ķ�����___________________��
��3����ͬѧ��ͼ2��������20��ʱһ��������NaCl������Һ����ˮ=1.0g/mL����
�����һ���������ò����������Ŀ����_____________________________��
����ͬѧ��Ϊ�������Ƶ���Һ�Dz�������Һ��������______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ķ�������ն��ġ�
SO2��һ����ɫ���д̼�����ζ��������ˮ�����塣SO2�Ǵ�����Ҫ��Ⱦ��֮һ�����γ��������Ҫ���ʡ���ͳ��, �ҹ�������93.9%��SO2 ����ú̿ȼ�ա�1998���ҹ���ʽȷ���˿���SO2��Ⱦ�����ߺʹ�ʩ����SO2�ŷ��������п��ơ�
����SO2��Ⱦ�ķ����У�ȼ����ȼ��ǰ����ȼ��������ȼ�պ�����( ����������)������������, �ǵ�ǰӦ����㡢Ч����ߵ�ʵ����������
��������һ��ɷ�Ϊ�ɷ���ʪ�������ࡣʪ������������ָӦ��Һ�����ռ�(��ˮ�������Һ)ϴ�Ӻ�SO2���������ѳ������е�SO2���ɷ���������, ��ָӦ�øɷ�״�����״���ռ�����������SO2������, ʹ�����е�SO2�����ա�
ʵ���ҿ�����ͼ1װ��ģ��ɷ���������ú���飬ʹ�������С���ȣ�ȡ3��0.5 gú�ۣ�����2�ݷֱ�����0.1g ̼��ơ�0.1g��ʯ��(CaO��NaOH)��Ϊ���ռ�����Ͼ��Ⱥ��������н���úȼ��ʵ�顣��SO2���������3��úȼ�չ��������ŷŵ�������SO2�ĺ���(��ͼ2)��
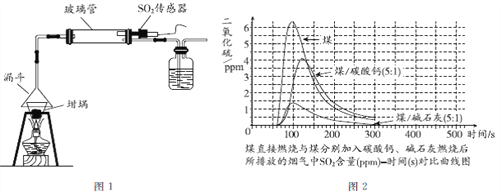
ʪ������������ŵ�������Ч�ʸ�, �ȶ���ȱ�����ܺĸߣ�����ɶ�����Ⱦ, �����ڷ�ˮ���������⡣�ɷ�����������ŵ����ܺĵ�,���չ��̼�, ����ˮ�����ᴦ������ȡ�
�����������ݣ��ش��������⣺
(1)�����е�SO2��Ҫ����___________��
(2)SO2������������______(���һ������)��
(3)�ɷ�����������ʹ�õ����ռ���ʯ������_________(�����������������������)��
(4)ʵ����ģ��ɷ���������ʱ�����ÿ�ѧ��ʵ���о�������______(д��һ�ַ�������)��
(5)����˵������ȷ����_____(����ĸ���)��
A������SO2����Ⱦֻ��ͨ���������������
B���ɷ�������������ʪ��������������������
C��ú�м��벻ͬ���ռ�����������SO2������Ч����ͬ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com